


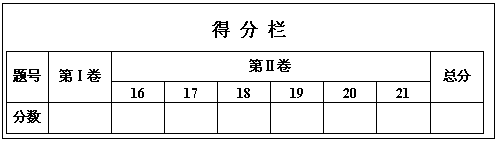
 化学试卷答题卡
化学试卷答题卡


 襄樊优质高中2009届高三联考
襄樊优质高中2009届高三联考
⑶若混合物中含0.15molCu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
⑷若混合物中Cu的物质的量为nmol,则n的取值范围为 。
21.(8分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应的化学方程式为:Cu2O+H2SO4=Cu+CuSO4+H2O。现向Cu、Cu2O和CuO组成的混合物中,加入2L0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到4480mLNO气体(标准状况)。请回答下列问题:
⑴写出Cu2O跟稀硝酸反应的离子方程式 。
⑵若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
⑵若实验前称取10g样品,测得SO2的质量为0.64g,则样品中Na2SO4质量分数为 ,该方法的缺点是 。(只答一点即可)
【方法二】加热转化法
称取ag样品,置于硬质玻璃管中通入氧气加热一段时间,Na2SO3被氧化为Na2SO4 ,则可能发生的化学反应方程式为 ;若冷却后称得固体质量为bg,则样品中Na2SO4质量分数为 ,该方法的缺点是 。(只答一点即可)
【方法三】测沉淀质量法
第一步:称取样品质量,置于小烧杯中;
第二步:向小烧杯中加入足量稀盐酸,加热;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第四步:干燥沉淀,并称取沉淀质量。
⑴方案中BaCl2能否改成Ba(NO3)2? (填“能”或“不能”);试简述原因 。
⑵简述洗涤沉淀的方法: 。
五、本大题包括1小题,共8分

采用如上图所示装置,通过实验测定生成SO 2的质量。
⑴A装置的名称 ,C中盛放的试剂是 ,E装置的作用是 。
20.(11分)某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数。
【方法一】测 SO2质量法
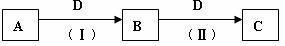
⑴若D为强氧化性单质,则A可能是 (填序号)
a. Na b. Mg c. Al d.S e.NH3
⑵若D为用途最广的金属单质,向C的溶液中滴加AgNO3溶液,产物不溶于稀硝酸的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量的D,理由是 ;检验B溶液中金属元素的离子方程式为 。
⑶若D为强电解质,A和C在溶液中反应生成的B是白色絮状沉淀,则B的化学式为 ,A和C反应的离子方程式是 。
19.(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(副产物已略去)。请按要求回答下列问题:

a b c d
⑷从所给元素中组成合适的反应物,用化学方程式表明元素M、R的非金属性强弱
。
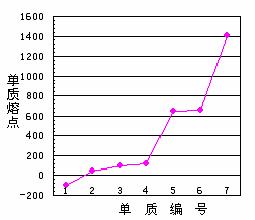
⑸第三周期主族元素单质熔点高低的顺序如右图所示,“1”所代表物质的化学式是
,“
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com