
【题目】已知氧气的密度为1.429g/L,空气的密度为1.293g/L,氮气的密度为1.250g/L。
请计算:
(1)空气中氧气的质量分数(保留一位小数)。_____
(2)空气中氧气与氮气的质量比(取整数)。______
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】六水合硫酸镍(NiSO4·6H2O)是一种重要的工业原料。该物质为绿色易溶于水的晶体,在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。该晶体可有含镍、铜、铁的电镀废渣为原料获得,主要流程如下:
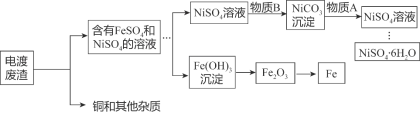
(1)由NiSO4溶液得到六水合硫酸镍晶体最好用加热浓缩,然后再降温结晶而不是蒸发结晶的原因____。
(2)电镀废渣中Fe与物质A发生反应的化学方程式为______________________________,该反应属于__________反应(填基本反应类型)。
(3)NiCO3沉淀转化为NiSO4溶液发生反应的化学方程式为____________________。
(4)该工艺流程还可制得Fe,214gFe(OH)3理论上能得Fe的质量为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“低碳”是全世界的主题。以下流程是通过控制化学反应的条件来促进或抑制化学反应实现“低碳”,从而更好地通过化学反应为人类造福。
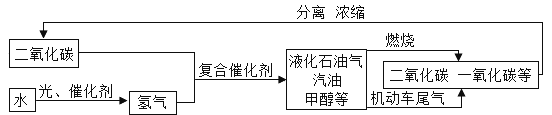
根据流程图回答下列问题:
(1)写出上述流程中水分解生成氢气和另一种单质气体反应的化学方程式____。
(2)甲醇(CH3OH)和乙醇都属于醇类,燃烧时都生成CO2,要证明甲醇燃烧的产物中有CO2,你设计的实验方案是____(要求写出步骤和现象)。
(3)控制条件可以使CO2和物质X发生化学反应:CO2+2X=CO(NH2)2+H2O,物质X的化学式为____。
(4)上图流程中可循环利用的物质是____。
(5)控制CO2的排放可有效地减缓温室效应,要减缓温室效应除大力植树造林,禁止乱砍滥伐外,还可以采取的有效措施有___。(答一点)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类生活离不开金属。
(1)铁是生活中常用的金属。如图是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热。

①发热剂需接触到空气才会发热,原因是铁要与_____、_____等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是__________________。
(2)应用金属活动性顺序能帮助我们进一步学习金属性质。
已知下列各组物质间均能发生置换反应。
AFe 和CuSO4 溶液 BMg和MnSO4 溶液 CMn和FeSO4 溶液
①写出Fe和CuSO4溶液反应的化学方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如右图所示。从图中所获信息不正确的是


A. 反应过程中有热量放出B. 50s时,溶液中溶质为AlCl3
C. 0~50s,发生Al2O3+6HCl===2AlCl3+3H2O反应D. 100—140s,压强减小是因为温度降低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知AgNO3与NaCl反应可生成AgCl,每次新生成的AgCl有10%见光分解成单质银和氯气,氯气又可在水中发生反应:3Cl2+3H2O→HClO3+5HCl,而生成的HCl与剩余AgNO3作用生成AgCl,这样循环往复直到最终。现有含1.1mol NaCl的溶液,加入足量的AgNO3溶液,则最终能生成难溶物(Ag和AgCl)的质量为________克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据图回答下列问题:
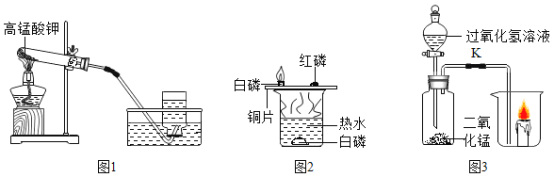
(1)图1为实验室用高锰酸钾制取氧气的装置。
①实验中反应的化学方程式为________。
②氧气可用排水法收集的原因是________。
(2)利用图2所示装置探究可燃物燃烧的条件(热水温度高于白磷着火点)。
①对比铜片上白磷燃烧和红磷不燃烧的现象,说明可燃物燃烧的条件之一是________。
②能说明可燃物燃烧需要与氧气接触的现象是________。
③烧杯中热水所起的作用是________。
(3)利用图3装置进行下列实验(烧杯中放着一支燃着的蜡烛),打开K。
①广口瓶中发生反应的化学方程式是________。
②观察到蜡烛_______,说明影响燃烧剧烈程度因素之一是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com