
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
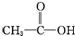 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④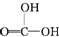 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.| 编号 | 实验操作 | 实验现象 | 实验结论 |
| (1) | 分别取上述四种物质的少量溶液或液体于试管中,各滴入几滴石蕊试液 | ||
| (2) | 分别取适量①④的水溶液各加入少量 NaHCO3固体 | ||
| (3) | 分别取少量②③的液体各加入一小粒金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com