
科目:高中化学 来源: 题型:
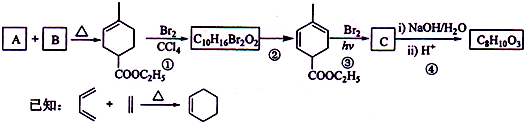
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KHSO4、Na2CO3、(NH4)2SO4、FeCl3 |
| B、K2CO3、MgCl2、Al2(SO4)3、KOH |
| C、NaCl、KCl、CuCl2、AgNO3 |
| D、NaOH、(NH4)2SO4、Na2SO4、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
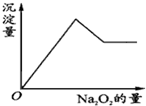 有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:
有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解--原未知试液中一定含有SO42- |
| B、某未知气体在空气中燃烧,其产物能使无水CuSO4变蓝色-原气体一定是H2 |
| C、在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得白色沉淀--原未知试液中一定含有CO32- |
| D、在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体--原未知试液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为放热反应,即a<0 |
| B、当平衡浓度符合c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当v(H2)=v(H2O)时该反应达到化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com