
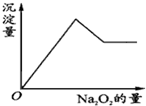
 有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:
有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Al3+ Fe2+ Ba2+ |
| 阴离子 | OH- Cl- SO42- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OH- NO3- I- HCO3- AlO2- HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3 溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH 溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2 溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Ba(NO3)2溶液产生白色的沉淀. |
| B、加入碘水变蓝 |
| C、加入Ba(NO3)2溶液没有白色沉淀 |
| D、加入碘水不变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com