
【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
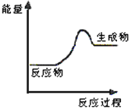
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
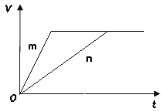
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
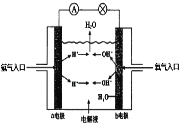
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
【答案】C B Zn或锌 氧化 2H++2e-=H2↑ bc X c 负极 a O2+4e-+4 H+=2H2O
【解析】
(2)一般放热的氧化还原反应可以设计成原电池;
(3)加有少量硫酸铜的溶液中Zn会置换出铜单质,从而形成原电池加快反应速率;
(4)原电池的负极上发生失电子的氧化反应,正极上发生得电子的还原反应,反应2H2+ O2=2H2O中氢气失电子被氧化,所以通入氢气的一极为负极,通入氧气的一极为正极。
(1)图示反应的反应物的总能量低于生成物的总能量,所以为吸热反应;
A.碳酸钙受热分解为吸热反应,但该反应中没有元素化合价发生变化,不是氧化还原反应,故A不符合题意;
B.金属与酸的置换反应为放热反应,故B不符合题意;
C.碳与二氧化碳的反应为吸热反应,且该过程有元素化合价发生变化,属于氧化还原反应,故C符合题意;
D.酸碱中和反应为放热反应,且该反应不是氧化还原反应,故D不符合题意;
答案选C。
(2)上述四个反应中,Zn+H2SO4=ZnSO4+H2↑为放热的氧化还原反应,可以设计成原电池;
①该反应中Zn被氧化,所以负极材料为Zn,原电池中负极失电子发生氧化反应;正极为氢离子得电子生成氢气的反应,电极反应式为2H++2e-=H2↑;
②电池的负极反应为Zn-2e-=Zn2+;正极反应为2H++2e-=H2↑,所以转移1mol电子时,生成0.5molZn2+和0.5molH2;
a.溶液增重的质量为0.5mol×65g/mol-0.5mol×2g/mol=31.5g,故a错误;
b.根据a可知溶液增重31.5g,故b正确;
c.析出氢气的质量为0.5mol×2g/mol=1g,故c正确;
d.未标明温度和压强,无法确定气体的体积,故d错误;
综上所述选bc;
(3)①曲线m表示的反应速率更快,滴有硫酸铜的稀硫酸中形成原电池,反应速率更快,所以曲线m代表X;
②根据分析可知Zn首先与Cu2+反应生成Cu,Cu与Zn、稀硫酸构成原电池加快反应速率,导致X比Y的反应速率快,所以选c;
(4)a电极通入氢气发生氧化反应,为负极;原电池中阴离子流向负极,所以硫酸根移向a极;b极上氧气得电子发生还原反应,电解质溶液为酸性溶液,所以生成水,电极反应式为O2+4e-+4 H+=2H2O。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,X 的最外层电子数是电子层数的2倍,Y和Z位于同一主族。甲、乙、丙为其中三种元素对应的单质,m、n、p均为由这些元素组成的二元化合物, n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略) 。下列说法正确的是

A.原子半径:W < X < Y
B.W与X组成的化合物中可能含有极性键和非极性键
C.Y与Z组成的化合物一定有漂白性
D.W与X、Y、Z组成的简单化合物的稳定性:X > Y > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
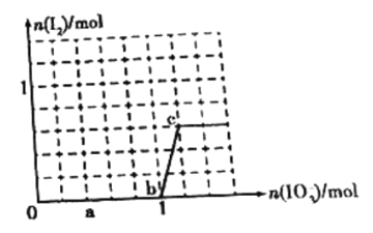
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
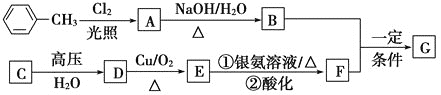
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com