


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
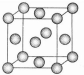 现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.
现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
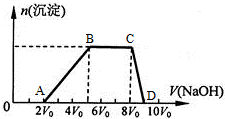
| 可能大量含有的阳离子 | H+、Ba2+、Al3+、NH4+、Fe2+ |
| 可能大量含有的阴离子 | Cl-、SO42-、NO3-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
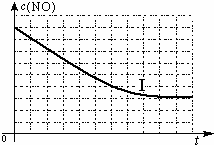
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol?L-1) | NaOH物质的量浓度 (mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com