|
试题详情
 ①B与C均存在同素异形体 ①B与C均存在同素异形体
②X的种类比Y的多 ③沸点:A的氢化物小于C的氢化物 ④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④ 试题详情
7.右图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入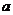 gM和 gM和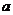 gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是(
) gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是(
) 试题详情
 A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液 A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液 C.t2℃时,M、N的物质的量浓度一定相等 D.t1℃时,M、N的溶质质量分数一定相等 试题详情
试题详情
A.称量氢氧化钠固体
B.检验铁粉与水蒸气反应产生的氢气 试题详情
C.配制150 mL 0.10 mol/L盐酸 D.分离两种互溶但沸点相差较大的液体混合物 试题详情
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意) 9.下列说法正确的是( ) A.微粒半径比较: F- > Na+ > Mg2+ B.SO 2和O3同时通入装有湿润的有色布条的集气瓶中,漂白效果一定更好 C.某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液不是氯水就是溴水 D.沸点高低比较为:H2O>HF>CH4 试题详情
10.下列各组离子在指定条件下,一定能大量共存的是( ) A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- 试题详情
11.下列离子方程式一定正确的是( ) A.NaHSO3溶液显弱酸性是因为:HSO3-+H2O=SO32-+H3O+ B.向Mg(HCO3)2溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2OH- = MgCO3↓+CO32-+2H2O 试题详情
C.氯化铝溶液水解显酸性:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ 试题详情
D.将0.1mol/LNa2CO3溶液数滴缓缓滴入0.1mol/L25mL盐酸中,并搅拌: 2H++CO32-==CO2↑+H2O 试题详情
12.一定条件下,在体积为10L的密闭容器中,投入1molX和1molY进行反应: 试题详情
 2X(s)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( ) 2X(s)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
试题详情
A.以X浓度变化表示的反应速率为0.001mol?L-1?s-1 B.其它条件不变,将容器体积变为20L,Z的平衡浓度小于原来的1/2 C.其它条件不变,若增大压强,则混合气体的平均摩尔质量不变 D.其它条件不变,若升高温度,Y的体积分数增大,则该反应的△H<0 试题详情
13.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法不正确的是( ) A.该电池Zn为负极,ZnO为正极,MnO2为催化剂 B.该电池中的电解质溶液可以是酸,也可以是碱 C.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH- D.导电时外电路电子由Zn流向MnO2 试题详情
14.①温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6。 试题详情
②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7。 下列说法中不正确的有( ) 试题详情
A.①中所得溶液中c(Cl―)-c(M+)=9.9×10―7mol/L B.①c(H+)-c(MOH)= 1×10―8mol/L C.由②中信息知MOH的电离程度<M+的水解程度 D.②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl―)> c(H+)>c(OH-) 第II卷(非选择题 共72分) 试题详情
三、填空题(本题包括6小题,共60分。) 15.(14分)(I)下列有关实验的叙述中,合理的是 ▲ (填序号) A.把SO2通入紫色石蕊试液,可验证SO2的漂白性 试题详情
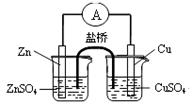 B.构成右图所示装置时,盐桥中的K+ 向左池移动 B.构成右图所示装置时,盐桥中的K+ 向左池移动
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 D.配制10%的ZnSO4溶液时,可将l0 g ZnSO4?7H2O 溶解在90 g水中 E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的 白色沉淀,则该溶液中一定含有SO42- F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高。 (II)一种新型高效净水剂PAFC――聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下图。 试题详情

请回答下列问题: (1)下列关于PAFC的说法中正确的是 ▲ A.PAFC是一种无机高分子化合物 B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱 D.PAFC在强酸性和强碱性溶液中均不能稳定存在 (2)步骤I中加入过量稀盐酸的目的一方面是使固体完全溶解,另一方面是 ▲ 。 (3)步骤II中取样分析的目的是测定溶液中Fe2+的含量,以确定加入NaClO3,写出向溶液中加入NaClO3时,发生反应的离子方程式为 ▲
。 (4)该化工厂的化验室为测定产品PAFC中Al和Fe两种元素的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有 ▲ 。 A.NH3?H2O
B.NaOH C.CO2 D.NaClO3 在测定过程中的操作顺序是:过滤、 ▲ 、灼烧、冷却、 ▲ 。 试题详情
16.(10分)(I)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO3-+4H++3e-→NO+2H2O. KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。 (1)写出并配平该氧化还原反应的方程式:
▲
。 (2)反应中硝酸体现了 ▲ 、 ▲ 性质。 试题详情
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 ▲ mol。 (II)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是: 试题详情
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol 试题详情
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-192.8kJ/mol 试题详情
由上述方程式可知,CH3OH的燃烧热的绝对值 ▲ (填“大于”、“等于”或“小于”)192.8kJ/mol。已知水的气化热为+44 kJ/mol,则氢气燃烧热的热化学方程式为 ▲
。 试题详情
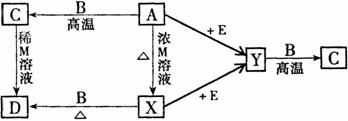 17.(10分)现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物,在一定条件下可发生下列转化: 17.(10分)现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物,在一定条件下可发生下列转化:
其中:X、Y为常见双原子气体单质(X为有色气体);B为常见金属单质,质软;C溶于强酸和强碱;E为由两种常见元素(按原子个数l:1)组成的液体;A为黑色化合物。上述各步转化中只写出其中一种生成物,其它生成物没有写出(也有可能反应只有一种生成物)。 试回答: (1)写出化学式:X ▲ , E ▲ 。 (2)写出离子方程式: A→X:
▲
; C与NaOH溶液反应:
▲
。 (3)X+E反应的化学方程式为
▲
。 试题详情
18.(8分)如图:横坐标为溶液的pH值,纵坐标为Zn2+
离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题。 (1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为
▲ 。 试题详情

(2)从图中数据计算可得Zn(OH)2的溶度积(K sp)= ▲ 。 (3)某废液中含Zn2+
离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 ▲ 。 试题详情
(4)往1L
1.00 mol?L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ▲ mol (精确到小数点后2位)。 试题详情
19.(8分)在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应: 试题详情
2X(g) + Y(g)  a Z(g) + W(g) △H= -Q kJ?mol-1 (Q>0) a Z(g) + W(g) △H= -Q kJ?mol-1 (Q>0) 当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则 (1)温度升高,平衡常数K的值是 ▲ (填“增大”、“减小”或“不变”)。 (2)化学计量数a的值为 ▲ 。 (3)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 ▲
(稀有气体不参与反应)。 A.2 molX、1mol Y、1molAr
B.a molZ、1mol W 试题详情
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ (4) X的转化率α= ▲ (用含Q、Q1的代数式表示)。 试题详情
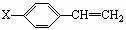
20.(10分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且具有强催泪作用的化学毒剂,它的结构式为: 试题详情
试题详情
已知R―CHOH―CH2OH R― R―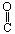 ―COOH ―COOH (1)苯氯乙酮分子中,在同一平面内的碳原子最多有 ▲ 个。 (2)苯氯乙酮不可能发生的化学反应是
▲ (用序号填充)。 A.取代反应 B.加成反应 C.水解反应 D.硝化反应 E.消去反应 (3)苯氯乙酮的一种同分异构体有如下转化关系: 试题详情

请写出:①B的结构简式 ▲ ,试剂Z为
▲
。 ②写出C→D转化的化学方程式:
▲
。 21(A).【物质结构与性质】 试题详情
四.选做题(本题包括2小题,考生只需选择其中一小题作答即可,若两小题都做,以第一小题计分。共12分)  铜及其合金是人类最早使用的金属材料。 铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。 ⑵右图是金属Ca和Cu所形成的某种合金的晶胞结构示意 图,则该合金中Ca和Cu的原子个数比为
▲ 。 ⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。 ① NH3分子的空间构型为 ▲ 。 ②[Cu(NH3)4]2+中存在的化学键类型有 ▲
(填序号)。 A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键 ③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。 ④某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲
。 21(B).【实验化学】 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题: 试题详情
(1) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 ▲ 溶液的烧杯中,充分搅拌后经 ▲ 、 ▲ (填操作方法)可得纯净的Mg(OH)2,需要用到的玻璃仪器有 ▲ 。 (2)下图是该兴趣小组设计进行过程③的实验装置图:其中装置A的作用是 ▲ 。 试题详情
(3)写出过程④中发生反应的化学方程式 ▲ 。 若不经过过程②③,而直接对MgCl2的水溶液进行过程④的操作,发生的离子反应方程式为 ▲ 。 江阴长泾中学2008-2009学年度第一学期12月考试 高三化学答案卷 题号 1~14 15 16 17 18 19 20 21 总得分 得分 试题详情
试题详情
2.请将第I卷的答案用黑色签字笔填写在相应的题号栏内 试题详情
3.请将第II卷的答案用黑色签字笔填写在相应的区域内,超出规定区域的答 案不得的分 第Ⅰ卷(选择题 共48分) 得
分 评卷人
试题详情
1~14.(48分)
题号 1 2 3 4 5 6 7 8 答案 题号 9 10 11 12 13 14 答案 第II卷(非选择题 共72分) 得
分 评卷人
试题详情
15.(14分)
(I) (填序号)。 (II)(1)
。 (2) 。
(3)
。 (4) 。 、 。 得
分 评卷人
试题详情
16.(10分)
(I)(1)
。 (2) 、 。 (3) 。 (II)
。
。 得
分 评卷人
试题详情
17.(10分)
(1) , 。 (2) ; 。 (3)
。 得 分 评卷人
试题详情
18.(8分)
(1) 。 (2) 。 (3) 。 (4) (精确到小数点后2位)。
得 分 评卷人 试题详情
19.(8分)
(1)
(填“增大”、“减小”或“不变”)。 (2) 。 (3) 。 (4)
(用含Q、Q1的代数式表示)。 得 分 评卷人 试题详情
20.(10分) (1)
。 (2)
(填序号)。 (3)①
,
。 ②
。 得分 评卷人
试题详情
21.(12分)
(A) ⑴ 。 ⑵ 。 ⑶①
。 ② (填序号)。 ③ 。 ④ 。 (B) ⑴ , 、
(填操作方法),
。 (2) 。 (3) 。 。 江阴长泾中学2008-2009学年度第一学期12月考试 高三化学答案 试题详情
1~14.(1~8题为单选题,每题3分;9~14题每题有一或两个答案,每题4分,有两个答案的选对一个得2分,只要有错误答案就不得分,共48分) 题号 1 2 3 4 5 6 7 8 答案 D B B D A C D B 题号 9 10 11 12 13 14 答案 AD C D CD AB D 试题详情
15、(14分) (I)CF(4分 选对一个得2分,选错一个扣2分,扣完为止,不出现负分) (II)(1)AD(2分 选对一个得1分,选错一个扣1分,扣完为止,不出现负分) (2)抑制Fe2+ 、Fe3+和Al3+的水解 (2分) (3)6Fe2++6H++ ClO3-=6 Fe3++Cl-+3H2O (2分) (4)BC (2分 选一个且正确得1分,有错不给分) 洗涤、称量 (2分) 试题详情
16.(10分) (I)(1)3Cu2O+2 NO3-+14H+== 6Cu2+ + 2 NO+7H2O (2分) (2)酸性,氧化性 (2分 每空1分) 试题详情
(3)0.6mol (2分) (II)大于
(2分) 试题详情
H2(g)+ 1/2 O2(g) = H2O(l);△H = -124.6kJ/mol (2分) 试题详情
17.(10分) (1)X:Cl2 (2分) E: H2O2 (2分) 试题详情
(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分) Mn2++Cl2↑+2H2O (2分) Al2O3+2OH-=2AlO2-+H2O (2分) (3)Cl2+H2O2=2HCl+O2 (2分) 试题详情
18.(8分) (1)Zn2++4OH-=[Zn(OH)4]2- (2分) (2)10-17 (2分) 试题详情
试题详情
试题详情
19.(8分) (1) 减小 (2分)
(2) 1 (2分) (3) A (2分,有错不给分) 试题详情
 (4)
(2分) (4)
(2分)
试题详情
20.(10分) (1)8 (2分) (2)E (2分 有错不给分) 试题详情
 (3)① (2分) (3)① (2分)
溴水(或溴的CCl4溶液) (2分) 试题详情
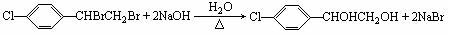
②
(2分 NaOH放在条件上也得分) 试题详情
21.(12分) (A)① ⑴1s22s22p63s23p63d104s1
(2分) ⑵ 1:5(2分) ⑶ ①三角锥形(2分) ②A、C (2分
选一个且正确得1分,有错不给分) ③平面正方型(2分) ④sp2 (2分) (B)(1) MgCl2(或氯化镁)
(2分)
过滤
洗涤 (2分 每空1分) 漏斗、烧杯、玻璃棒 (2分 填对2项得1分,有错不得分) (2)制备干燥的HCl气体 (2分) (3)MgCl2 == Mg + Cl2↑(2分) Mg2+
+ 2Cl- + 2H2O == Mg(OH)2↓ + H2↑ + C
l2↑ (2分) 试题详情
| 
 B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。 2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是(
)
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是(
) 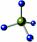 A.F原子结构示意图:
B.CH4分子的球棍模型
A.F原子结构示意图:
B.CH4分子的球棍模型 C.H、D、T表示同一种核素 D.次氯酸电子式 :
C.H、D、T表示同一种核素 D.次氯酸电子式 :