
2009届广东省汕头市金山中学高三上学期期末测试化学试题
第Ⅰ卷(选择题,共63分)
一.选择题(本题包括9小题,每题3分,共27分。每小题只有一个选项符合题意)
2.浅绿色的Fe(NO3)2溶液中,存在水解平衡:Fe2++2H2O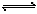 Fe(OH)2+2H+。若在此溶液中加入盐酸,则溶液颜色
Fe(OH)2+2H+。若在此溶液中加入盐酸,则溶液颜色
A.浅绿色略变深 B.颜色基本不变 C.变黄 D.变为红褐色
3.2007年诺贝尔化学奖授予德国科学家格哈德?埃德尔是因为他在表面化学所作的开创性研究。下列选项与物质的表面特征无关的是
A.用明矾来净水
B.硫酸工业生产中送进沸腾炉的矿石被粉碎成细小的矿粒
C.用还原铁粉和石棉绒混合与水蒸气反应制Fe3O4和H2
D.配制FeCl3溶液时,将FeCl3固体溶于浓盐酸中再加水稀释
4.2H.13C.15N.18O.34S等常用做环境分析指示物,下列对它们的说法正确的是
A.34S原子核内的中子数为16 B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2 D.2H2.1H2互为同位素
5. 下列物质的分类正确的是
混合物
非电解质
碱
酸式盐
A
冰醋酸
Cl2
氨水
NaHCO3
B
福尔马林
苯
泡花碱
明矾
C
胆矾
SO2
纯碱
NH4Cl
D
食醋
C2H5OH
苛性钾
NaHSO4
6.对H2O的电离平衡不产生影响的粒子是
7.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱性物质
8.某溶液中由水电离生成的c(H+)=10-12 mol/L,下列各组离子一定不能大量共存的是
A.Na+.AlO2-.Cl-.SO42- B.Mg2+.Ca2+.HCO3-.Cl-
C.K+.Fe2+.SO42-.Br- D.Fe3+.Ca2+.Cl-.NO3-
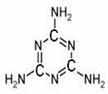 9.化学工作者和社会各界都一直关注食品安全问题,目前国内的“三鹿毒奶粉”事件是不法奶商向原奶中加入了三聚氰胺,其结构简式如右下图。已知氨分子为三角锥型,下列关于三聚氰胺的说法不正确的是
9.化学工作者和社会各界都一直关注食品安全问题,目前国内的“三鹿毒奶粉”事件是不法奶商向原奶中加入了三聚氰胺,其结构简式如右下图。已知氨分子为三角锥型,下列关于三聚氰胺的说法不正确的是
A.含有不饱和碳原子,在一定条件下能发生加成反应
B.不法分子因为三聚氰胺含氮量较高才用其造假
C.分子中所有原子都在同一平面上
D.三聚氰胺属于有机物
10.下列叙述正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.酸和盐反应一定生成一种新酸和一种新盐
C.酸和碱反应一定只生成盐和水
D.有单质参加的化合反应一定是氧化还原反应
二.选择题(本题包括9小题,每小题4分,共36分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得满分,但只要选错一个.该小题就为0分)
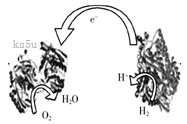 11.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
11.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的正极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2―2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
12.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液一定有CO32-
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液一定有NH4+
C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,原溶液一定有Ba2+
13.美丽的“水立方”(Water Cube)是北京奥运会游泳馆,采用膜材料ETFE(四氟乙烯和乙烯的共聚物),为场馆带来更多的自然光。下列说法正确的是
A.ETFE的结构中,存在―CF2―CF2―CH2―CH2―连接方式
B.四氟乙烯与乙烯发生缩聚反应得到ETFE
C.以乙烯为原料经过加成反应.取代反应可制得乙二醇
D.ETFE材料是热固型(体型结构)的塑料
14.下列有关阿伏加德罗常数的叙述正确的是
A.1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
B.23 g Na和足量的O2完全反应,无论是常温还是燃烧,都失去6.02×1023个电子
C.常温常压下,36gC5H12分子中含有8×6.02×1023个共价键
D.12.5 mL 16 mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
15.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
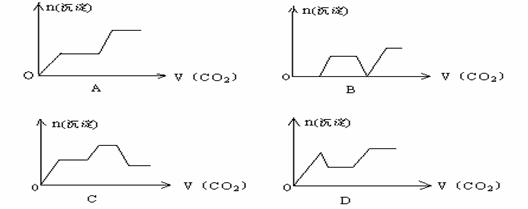 16.将足量的CO2不断通入KOH.Ca(OH)2.KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
16.将足量的CO2不断通入KOH.Ca(OH)2.KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
17.下列离子方程式正确的是
A.过量铁粉溶于稀HNO3中:Fe+NO3-+4H+=Fe3++NO↑+2H2O
B.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O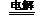 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.少量C12通入FeBr2溶液中:2Fe2++C12=2C1―+2Fe3+
D.过量NaHSO4溶液加入到Ba(OH)2溶液中2H++ SO42-+Ba2++2OH―=2H2O+BaSO4↓
18.25℃时,某物质(无结晶水)溶解度为S g,其摩尔质量为M g/mol,饱和溶液密度为d g/cm3。则其饱和溶液的物质的量浓度为
A.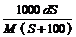 mol/L B.
mol/L B.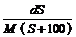 mol/L
mol/L
C.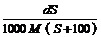 mol/L
D.
mol/L
D.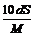 mol/L
mol/L
第Ⅱ卷(非选择题,共83分)
三.(本题包括3小题,共32分)
|