
科目:gzhx 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:013
|
已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×10-10、5.0×10-13、8.3×10-17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX=-lgc(X-)],就可绘得滴定曲线.现以0.1 mol·L-1 AgNO3溶液分别滴定20.00 mL 0.1 mol·L-1 Cl-、Br-、I-绘得滴定曲线如图,下列有关说法中正确的是
| |
| [ ] | |
A. |
a、b、c分别表示Cl-、Br-、I- |
B. |
a、b、c分别表示I-、Br-、Cl- |
C. |
a、b、c分别表示Br-、I-、Cl- |
D. |
用硝酸银滴定法测定试样中c(Cl-),可用KI作指示剂 |
科目:gzhx 来源: 题型:
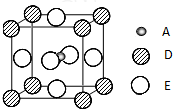 (2010•泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010•泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:
| A、边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | B、当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | C、上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | D、滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
科目:gzhx 来源:2010-2011学年福建省龙岩一中高二第四学段模块考试化学试卷 题型:填空题
(11分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
________________________________________________________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________________;
(3)测定样品中Cl-含量的方法是:
a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中需用溶液润洗的仪器有__________________ ______________,
______________,
②计算上述样品中CaCl2·2H2O的质量分数为________________;
(4)已知t℃时,纯水中c(H+)=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积[Ksp[Mg(OH)2]=3.2×10- 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
科目:gzhx 来源:2013-2014学年高考化学三轮复习排查 专题9非金属元素及其化合物练习卷(解析版) 题型:填空题
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。

已知:2Mg+CO2 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白:
(1)A的化学式________。
(2)写出反应②的化学方程式:________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式:_________________________________________。
(5)在反应④中,当生成标准状况下2.24 L G时,转移电子数为________ mol。
科目:gzhx 来源: 题型:
A已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 ▲ (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 ▲ 。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ▲ ;该晶体的化学式为 ▲ 。
科目:gzhx 来源: 题型:
(12分)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.(12分)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 ▲ (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
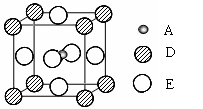 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 ▲ 。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ▲ ;该晶体的化学式为 ▲ 。
科目:gzhx 来源: 题型:
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 ▲ (填元素符号)。
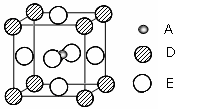 ⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 ▲ 。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ▲ ;该晶体的化学式为 ▲ 。
科目:gzhx 来源:江苏省泰州南通2010届高三第三次模拟考试化学试题 题型:022
已知:
A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是
________(填元素符号).(2)
B的氢化物的沸点远高于A的氢化物的主要原因是________.(3)
由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________.(4)E2
+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有________.(5)
最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性.A原子的配位数为________;该晶体的化学式为________.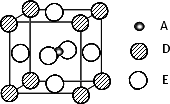
科目:gzhx 来源:2012届浙江省杭州高级中学高三第三次月考化学试卷 题型:单选题
已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×l0-l0、5.O×10—13、8.3×10—17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX= -lgc(X )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl 、Br
、Br 、I
、I 绘得滴定曲线如图,下列有关说法中正确的是
绘得滴定曲线如图,下列有关说法中正确的是
A.a、b、c分别表示Cl 、Br 、Br 、I 、I |
B.a、b、c分别表示I 、Br 、Br 、Cl 、Cl |
C.a、b、c分别表示Br 、I 、I 、Cl 、Cl |
D.用硝酸银滴定法测定试样中c(Cl ),可用KI作指示剂 ),可用KI作指示剂 |
科目:gzhx 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H > 0
B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极
C.常温下,0.1mol·L-1 CH3COOH溶液pH=1
D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小
科目:gzhx 来源:2013-2014学年河北省高三第五次月考化学试卷(解析版) 题型:选择题
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是( )
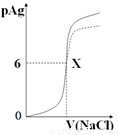
(提示:KspAgCl>KspAgI)
A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B.图中x点的坐标为(100,6 )
C.图中x点表示溶液中Ag+ 与Cl- 浓度相同
D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分
科目:gzhx 来源:2012-2013学年湖南省名校高三9月第一次联考化学试卷(解析版) 题型:选择题
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L 的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是

(提示:KspAgCl>KspAgI)
A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6 )
C. 图中x点表示溶液中Ag+ 被恰好完全沉淀
D.把0.1 mol·L-1 的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分
科目:gzhx 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是

A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)= c(CO32-)
C.b 点可表示CaCO3 的饱和溶液,且c(Ca2+)<c(CO32-)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-)
科目:gzhx 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:013
已知在稀溶液中,c(H+)·c(OH-)=KW,而溶液的pH=-lg{c(H+)}.0℃时,1 mol/L的NaOH溶液中KW=10-15,则溶液的pH是
[ ]
科目:gzhx 来源:2013届湖南省湘中名校高三9月第一次联考化学试卷(带解析) 题型:单选题
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是
(提示:KspAgCl>KspAgI)
| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 被恰好完全沉淀 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
科目:gzhx 来源: 题型:单选题

科目:gzhx 来源: 题型:


科目:gzhx 来源:2014届四川省资阳市高二上学期期末检测化学试卷(解析版) 题型:简答题
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g) △H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。