
题目列表(包括答案和解析)
25.(14分)(1)载体蛋白 (2分) b (2分) a、d(2分)
(2)一定的流动性 (2分) D(2分) (3)通透性(2分) D(2分)
24.(14分)(1)蔗糖酶 淀粉酶(或答唾液淀粉酶 α-淀粉酶)(4分)
(2)现象:可能A、B都不能形成砖红色沉淀 (2分)
原因:①先加斐林试剂再加酶,斐林试剂可能对酶活性有影响 (2分)
②加入酶溶液后,直接加热煮沸,既可能使酶不能充分催化反应,又可能使酶失去活性而无催化作用…………………………(2分)
(3)1→2→4→适应温度条件下,保温5min→3→5→6 (4分)
23.(18分)(1)铁板刚好不动时,以人为研究对象,设人受铁板的静摩擦力为f,人跑动的
加速度为a,根据牛顿第二定律有 f=ma ① ……2分
设人对铁板的静摩擦力为f′,根据牛顿第三定律有 f′= f ② ……1分
以铁板为研究对象,根据力的平衡有 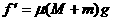 ③ ……2分
③ ……2分
联立①②③解得人的加速度 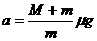 ……3分
……3分
(2)设人跑到另一端骤然停止前时的速度大小为v,根据匀加速运动速度一位移关系,有 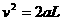 ④ ……2分 解得
④ ……2分 解得 ……2分
……2分
(3)人骤然停止跑动时,人和铁板系统动量守恒,设人和铁板的共同速度为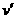 ,有
,有
 ⑤ …… 2分
⑤ …… 2分
设铁板向前滑动的最大距离为s,由动能定理
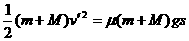 ⑥ ……2分 解得
⑥ ……2分 解得 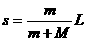 ……2分
……2分
以下为评分参考,阅卷时可依题意,选择其它合理答案:
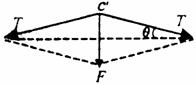
22.(18分)(1)设c′点受两边绳的张力为T1和T2,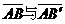 的夹角为θ,如图所示。依对称性有 T1=T2=T
由力的合成有 F=2Tsinθ ① ……4分
的夹角为θ,如图所示。依对称性有 T1=T2=T
由力的合成有 F=2Tsinθ ① ……4分
根据几何关系有 sinθ=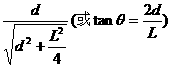 ② ……4分
② ……4分
联立①②解得 T=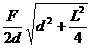 ③ ……4分
③ ……4分
因d<<L,故  ④ ……2分
④ ……2分
说明:根据①②式,运用近似运算sinθ≈tanθ,得出④,第(1)问得14分。
(2)将d=10mm,F=400N,L=250mm代入③或④,解得 T=2.5×103N ⑤ ……4分
即绳中的张力为2.5×103N
21.(20分)
(1)电阻R;电阻箱R1…………8分
(2)r ……4分 (3)3.81 ……4分
(4)5.26 ……4分
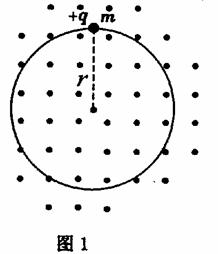
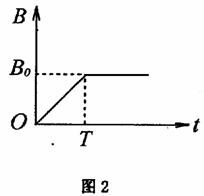
32.(22分)质量为 、带电荷量为+
、带电荷量为+ 的绝缘小珠,穿在半径为
的绝缘小珠,穿在半径为 的光滑圆形轨道上,轨道
的光滑圆形轨道上,轨道
平面水平,空间有分布均匀且随时间变化的磁场,磁场方向竖直向上,如图1所示. 磁
感应强度B(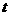 )的变化规律如图2所示.
)的变化规律如图2所示.
(1)若圆环由金属材料制成,求圆环上感应电动势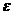 的大小,
的大小,
(2)若圆环由绝缘材料制成,已知在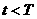 内,圆环处的感应电场的场强方向是沿顺时针并
内,圆环处的感应电场的场强方向是沿顺时针并
指向圆环的切线方向、大小为E=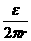 ,
,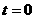 时刻小珠静止.求
时刻小珠静止.求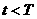 时,轨道对小珠
时,轨道对小珠
的作用力F 的大小(小珠重力不计).
理科综合答案及评分参考
 1.A
2.C 3.A 4.B
5.D 6.D 7.C
8.D 9.A 10.D 11.B 12.C 13.A 14.C 15.D 16.C 17.B 18.D 19.B 20.D
1.A
2.C 3.A 4.B
5.D 6.D 7.C
8.D 9.A 10.D 11.B 12.C 13.A 14.C 15.D 16.C 17.B 18.D 19.B 20.D
30.(14分)在一容积为2.0L且容积不变的密闭容器中加入适量碳粉和0.20mol H2O。
在800℃条件下,经20s后达到如下化学平衡(第一平衡):
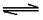 C(s)+H2O(g)
CO(g)+H2(g);△H>O
C(s)+H2O(g)
CO(g)+H2(g);△H>O
已知平衡时,CO为0.12mol。试填空:
(1)若用 (H2O)表示该反应前20s内平均速率,则
(H2O)表示该反应前20s内平均速率,则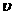 (H2O)=
。
(H2O)=
。
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(第二平
衡),则平衡时H2的物质的量 (填“增大”“减小”或“不变”)。理由是
。
(3)若向上述第一平衡的混合物中再充入amolH2(a<0.12)在相同条件下达到新的平衡(第
三平衡)此时,CO的物质的量n的联欢会范围是 。
|
备反应原理为:Al2O3+N2+3C 2AlN+3CO。制备过程中,原料配比不当或反应不完
全等因素都会造成产品中含有碳或Al2O3等杂质。为测定产品中AlN的质量分数,某同
学按下图装置进行相关实验。可选用的化学试剂为:
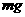 氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
 回答下列问题:
回答下列问题:
(1)简述检查该套装置气密性的方法
。
(2)右图B中试剂最好选用(填序号):
。
①水 ②煤油 ③医用酒精
已知A 中有NaAlO2生成,并放出有刺激性气
味气体,写出A中发生反应的化学方程式
。
(3)读取C(量筒)中液体体积时,应注意 。(填序号)
a.C中液面不再上升时立即读数 b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出 d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已
折算成标准状况),则AlN样品的纯度为 (写计算表达式)。
(5)上述实验方案,可能因气体体积测量不准,导致误差较大。有人建议改用下列A、B两
个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就
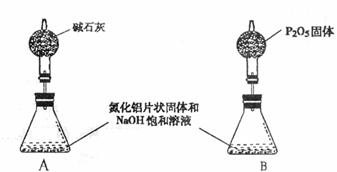 可比较准确确定样品中AlN的质量分数。较合理的装置是:
(填代号)。
可比较准确确定样品中AlN的质量分数。较合理的装置是:
(填代号)。
29.(12分)据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中
间产物,其合成路线为:

|
 (Ⅰ)RNH2+
(Ⅰ)RNH2+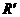 CH2Cl
RNHCH2
CH2Cl
RNHCH2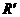 +HCl(R和
+HCl(R和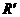 代表烃基)
代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
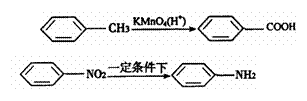
(Ⅲ) (苯胺,弱碱性,易氧化)
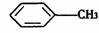
(Ⅳ) 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
回答下列问题:
(1)C的结构简式是 。
(2)D+E→F的化学方程式:
。
(3)E在一定条件下,可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程
。
(4)反应①~⑤中,属于取代反应的是(填反应序号) 。
28.(12分)已知:下图中的物质均为中学化学中常见物质;常温下,A、C、F、H、J、K
为固体,D、G为气体;A为常见金属单质;B为重要的工业原料,可用于制备炸药,
其浓溶液通常呈黄色;E的溶液呈黄色;C、D均为由两种短周期元素组成的化合物;G
 为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已
为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已
略去)。
试填空:
(1)B的名称 ;A在周期表中的位置 。
|
 离子反应方程式:E+F H+I+D:
。
离子反应方程式:E+F H+I+D:
。
27.(12分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。
运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢
元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为 。
(2)若64g该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,
还放出3000kJ的热量。写出该反应的热化学方程式 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮
氢化合物通入足量盐酸时,发生反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com