
题目列表(包括答案和解析)
32.(8分)[化学--物质结构与性质]
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着
个 键和
个
键和
个 键;
键;
(3)磷、氮、氧是周期表中相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②N2分子中氮氮键的键长 (填“大于”、“小于”或“等于”)白磷分子中磷磷键的键长;
(4)氮元素的氢化物--NH3是一种易液化的气体,氨分子中氮原子杂化类型为
杂化,该气体易液化的原因是 。
31.(8分)[化学--化学与技术]
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
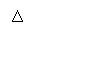
2NaHCO3 Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据 上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
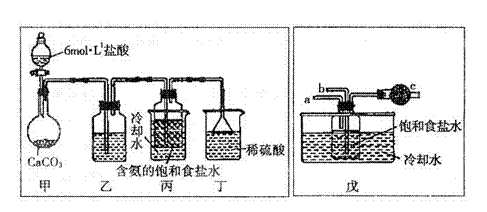 实验结束后,分离出NaHCO3晶体的操作是
(填分离操作的名称)。
实验结束后,分离出NaHCO3晶体的操作是
(填分离操作的名称)。
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
30.(16分)下图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择。
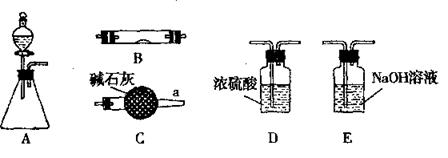
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、 。
②检查好装置的气密性后加热B前必须进行的操作是 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右连接顺序A→C→B→C,请写出B中氨的催化氧化反应方程式 。
②装置B中可能观察到的现象是 。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。
①若SO2与过氧化钠反应生成O2,则反应的方程式可能为: ;
②根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):
A→( )→( )→( ),装置B中可能观察到的现象是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
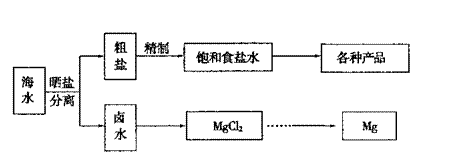
29.(12分)海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消互液仅含一种溶质,写出该电解的化学方程式: 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为 ,控制溶液的pH为 。
28.(14分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原了半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
,用离子方程式表示X溶液呈酸性的原因是 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体已知[n(A):n(B)=3:1],可以放出18.44kJ热量,则该反应的热化学方程式为 。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为 。
 (5)在10L的密闭容器中,通入2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为
。
(5)在10L的密闭容器中,通入2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为
。
27.(16分)兔子的毛色有灰色、青色、白色、黑色、褐色等,控制毛色的基因在常染色体上。其中,灰色由显性基因(B)控制,青色(b1)、白色(b2)、黑色(b3)、褐色(b4)均为B基因的等位基因。
(1)兔子不同毛色基因b1、b2、b3、b4 的根本来源是____________________,该现象说明该变异的特点之一是_________________。遗传时B与b1、b2、b3、b4之间遵循_____________定律。
(2) 已知b1、b2、b3、b4之间具有不循环但有一定次序的完全显隐性关系(即如果b1对b2显性、b2对b3显性,则b1对b3显性)。为探究b1、b2、b3、b4之间的显性关系,有人做了以下杂交试验(子代数量足够多,雌雄都有):
甲:纯种青毛兔×纯种白毛兔→F1为青毛兔
乙:纯种黑毛兔×纯种褐毛兔→f1为黑毛兔
丙:F1青毛兔×f1为黑毛兔
请推测杂交组合丙的子一代可能出现的性状,并结合甲、乙的子代情况,对b1、b2、b3、b4之间的显隐性关系做出相应的推断:
①若表现型及比例是 ,则b1、b2、b3对b4显性,b1、b2对b3显性,b1对b2显性(可表示为b1>b2>b3>b4,以下回答问题时,用此形式表示)
②若青毛︰黑毛︰白毛大致等于2︰1︰1,则b1、b2、b3、b4之间的显隐性关系是 。
③若黑毛︰青毛︰白毛大致等于2︰1︰1,则b1、b2、b3、b4之间的显隐性关系是 。
(3)假设b1>b2>b3>b4。若一只灰色雄兔与群体中多只不同毛色的纯种雌兔交配,子代中灰毛兔占50%,青毛兔、白毛兔、黑毛兔和褐毛兔各占12.5%。该灰毛雄兔的基因型是 。若让子代中的青毛兔与白毛兔交配,后代的表现型及比例是 。
26.(17分)2008年10月,海南省部分市县发生了霍乱疫情。霍乱是霍乱弧菌引起的烈性传染病,霍乱弧菌主要通过污染水源或鲜鱼、贝壳类食物而引起烈性肠道感染,它产生的霍乱肠毒素导致小肠液过度分泌,严重者上吐下泻,导致脱水和代谢性酸中毒,甚至休克死亡。患过霍乱的人可获得长久的免疫力,再感染的较为少见。有研究小组做了以下实验。
向健康正常的实验小鼠注射毒性弱霍乱菌苗,这些小鼠感染后没有发病。四天后,对实验小鼠注射毒性极强的霍乱弧菌制剂,一段时间后实验小鼠全部正常生活。
请分析回答下列问题:
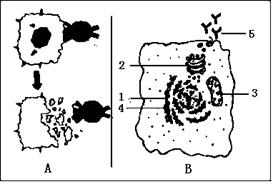 (1)实验中毒性弱的霍乱菌苗进入小体内,使体内产生了相应的免疫活性物质,该过程曾出现下图
(填A或B)所示的现象。
(1)实验中毒性弱的霍乱菌苗进入小体内,使体内产生了相应的免疫活性物质,该过程曾出现下图
(填A或B)所示的现象。
(2)写出与图B中5的产生有关的所有细
胞名称: 。
(3)实验二中向实验小鼠第二次注射毒性极
强的霍乱弧菌制剂后没有发病,但会在
实验小鼠体内发生一系列重要的生理
反应,其中主要的是
。你认为要使实验更具说服
力,应补充的实验操作是 。
(4)要防止霍乱病的发生和传染,你可做到的是 。
(5) 霍乱弧菌在生态系统中属于____________者,其细胞内能发生碱基互补配对的细胞结构有________________________________________。
25.(18分)如图所示,水平桌面上有一轻弹簧,左端固定在A点,自然状态时其右端位于B点。水平桌面右侧有一竖直放置的光滑轨道MNP,其形状为半径R=0.8m的圆环剪去了左上角135°的圆弧,MN为其竖直直径,P点到桌面的竖直距离也是R。用质量m1=0.4kg的物块将弹簧缓慢压缩到C点,释放后弹簧恢复原长时物块恰停止在B点。用同种材料、质量为m2=0.2kg的物块将弹簧缓慢压缩到C点释放,物块过B点后其位移与时间的关系为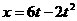 ,物块飞离桌面后由P点沿切线落入圆轨道。G=10m/s2,求:
,物块飞离桌面后由P点沿切线落入圆轨道。G=10m/s2,求:
(1)BP间的水平距离。
(2)判断m2能否沿圆轨道到达M点。
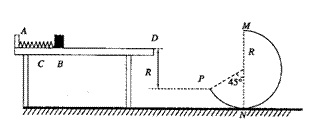 (3)释放后m2运动过程中克服摩擦力做的功
(3)释放后m2运动过程中克服摩擦力做的功
24.(15分)如图所示,一根电阻为R=18Ω的电阻丝做成一个半径为r=1m的圆形导线框,竖直固定放置在磁感应强度B=0.5T的匀强磁场中,磁场垂直于线框平面并且分布在如图所示两竖直虚线范围内。现有一根质量为m=1.0kg,电阻不计的导体棒,自圆形线框ab位置由静止沿线框平面下落,下落过程中始终保持水平并与线框保持良好光滑接触。经过圆心O时棒的加速度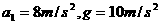 。求:
。求:
(1)导体棒经过圆心O时的速度。
 (2)若导体棒从ab位置下落到cd位置的过程中,线框中产生的热量Q=0.48J,则导体棒经过cd时的加速度多大?
(2)若导体棒从ab位置下落到cd位置的过程中,线框中产生的热量Q=0.48J,则导体棒经过cd时的加速度多大?
23.(12分)某实验小组探究一种热敏元件的电阻随温度变化的特性。现有器材:直流恒流电源(在正常工作状态下输出的电流恒定并且可读出其大小)、电压表、特测元件、保温容器、温度计、开关和导线等。
 (1)若用上述器材测量该元件的阻值随温度变化的特性,请你在答题纸对应图中用笔连线画出实物连接图。
(1)若用上述器材测量该元件的阻值随温度变化的特性,请你在答题纸对应图中用笔连线画出实物连接图。
(2)实验的主要步骤:
①正确连接电路,在保温容器中注入适量冷水,接通电源,调节并记录电源输出的电流值;
②在保温容器中添加少量热水,待温度稳定后,闭合开关,记录 和 ,断开开关;
③重复第②步操作若干次,测得多组数据。
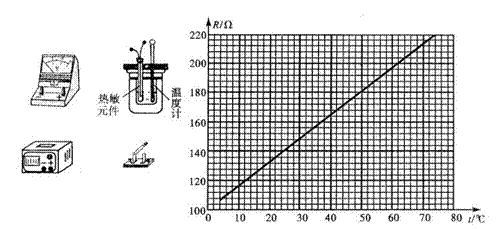
(3)实验小组测得该元件在不同温度下的阻值。并据此绘得上图的R-t关系图线,请根据图线写出该元件的R-t关系式:R= 。
(4)由以上方法测得的电阻值比它的真实值偏 。
(5)如果实验室提供的恒定电流源的输出电流为65mA,但没有合适的电压表,应选用如下哪组器材测量热敏元件上的电压? 。
A.电压表V1:量程3V、内阻3kΩ,定值电阻R1=6 kΩ
B.电压表V2:量程5V、内阻5kΩ,定值电阻R2=10 kΩ
C.电压表V3:量程10V、内阻10kΩ,定值电阻R3=1 kΩ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com