
题目列表(包括答案和解析)
5.下图是“白菜-甘蓝”杂种植株的培育过程。下列说法正确的是
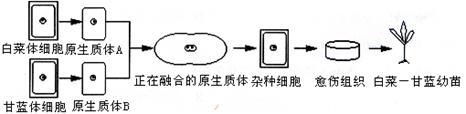 A.植物体细胞杂交技术已经能使杂种植物按照人们的需要表现出亲代的优良性状
A.植物体细胞杂交技术已经能使杂种植物按照人们的需要表现出亲代的优良性状
B.植物组织培养和动物细胞培养的培养基、培养目的不完全相同,但诱导细胞或原生质体融合的方法却是相同的。
C.杂种细胞、愈伤组织和幼苗都能进行光合作用,在由杂种细胞形成杂种植株的过程
中始终需要适宜的光照、适宜的温度、植物激素和无菌等条件.
D.杂种细胞、愈伤组织和幼苗状态下细胞内的遗传物质相同,所表达的基因却不是相
同的。
4.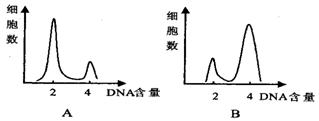 A图表示某种哺乳动物细胞在正常培养时,所测得的细胞中DNA含量与细胞数的变化。当用某种化合物处理该培养着的细胞,结果DNA含量与细胞数的变化如B图所示,该化合物所起的作用是
A图表示某种哺乳动物细胞在正常培养时,所测得的细胞中DNA含量与细胞数的变化。当用某种化合物处理该培养着的细胞,结果DNA含量与细胞数的变化如B图所示,该化合物所起的作用是
A.抑制DNA的复制 B.促进细胞分裂
C.促进DNA的高度螺旋化 D.抑制纺锤体的形成
3.人进食后,下列哪一现象在胰腺细胞中不会出现
A.线粒体产生的能量增加 B.内质网和高尔基体的联系加强
C.细胞核中DNA加快复制 D.核糖体的功能增强
2.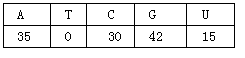 对绿色植物根尖细胞某细胞器的组成成分进行分析,发现A、T、C、G、U五种碱基如右表所示,则该细胞器完成的生理活动是
对绿色植物根尖细胞某细胞器的组成成分进行分析,发现A、T、C、G、U五种碱基如右表所示,则该细胞器完成的生理活动是
A.C6H12O6+6O2+6H2O-→6CO2+12H2O+能量 B.mRNA→蛋白质
C.DNA-→mRNA D.CO2+H2O-→(CH2O)+O2
1.关于构成生物体的元素及化合物的叙述中,正确的是
A.葡萄糖存在于叶绿体而不存在于线粒体中
B.植物对钙离子的需要量极少,但仍属于必需元素
C.癌细胞是一种失控细胞,其自由水含量较正常细胞低
D.C是组成生物体的最基本元素,它在生物体中的含量最多
30、(15分)
化合物H是一种香料,存在于金橘中,可用如下路线合成:
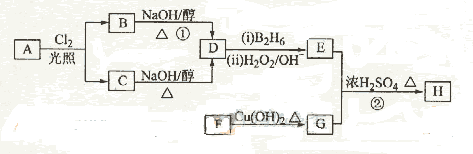
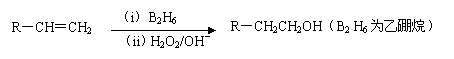
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。
A的分子式是________________
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为___________________________________________________;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是_____________
(4)反应①的反应类型是__________________;
(5)反应②的化学方程式为__________________________
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
答案.(1)C4H10。(2)2-甲基-1-氯丙烷、2-甲基-2-氯丙烷(3)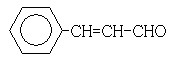 (4)消去反应。
(4)消去反应。
(5)
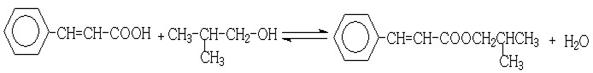
(6)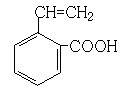 、
、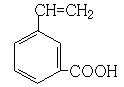 、
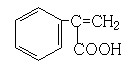
、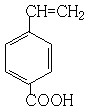 、
、
[解析](1)88gCO2为2mol,45gH2O为2.5mol,标准11.2L,即为0.5mol,所以烃A中含碳原子为4,H原子数为10,则化学式为C4H10。(2)C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照取代时有两种产物,且在NaOH醇溶液作用下的产物只有一种,则只能是异丁烷。取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷。(3)F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键。从生成的产物3-苯基-1-丙醇分析,F的结构简式为
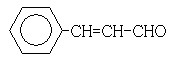 。(4)反应①为卤代烃在醇溶液中的消去反应。(5)F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为
。(4)反应①为卤代烃在醇溶液中的消去反应。(5)F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为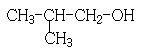 。E与G在浓硫酸作用下可以发生酯化反应。(5)G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
。E与G在浓硫酸作用下可以发生酯化反应。(5)G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
本资料由《七彩教育网》 提供!
29、(15分)
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_________________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_______________;
(3)R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是___________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)___________________,其原因是___________________
②电子总数相同的氢化物的化学式和立体结构分别是________________________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
____________________________________
答案.(1)原子晶体。(2)NO2和N2O4(3)SO3。(4)①NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O分别为三角锥和V形;SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。Y为O,所以R的最高价化合物应为SO3。(4)显然D为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
28、(15分)
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
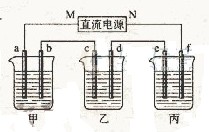
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为_________________________;
③列式计算电极b上生成的气体在标准状况下的体积:
_________________________________
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
______________________________________。
答案. (1)①正极 ②4OH--4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。(2)可以
[解析](1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
27、(15分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
2H2SO4(浓)+C  CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
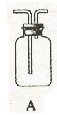
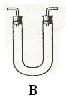

将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
|
|
|
答案. C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 品红 检验SO2是否除尽
A 澄清石灰水 检验CO2的存在。
[解析]成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,然后再用装置A,放入品红,检验品红是否除尽,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,故先要除去SO2。
13、下图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:
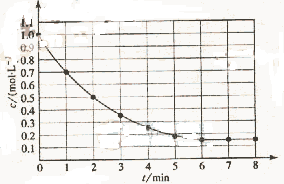
下列有关该反应的描述正确的是
A.第6 min 后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
答案.B
[解析]A项,6min时反应达平衡,但未停止,故错;B项,X的变化量为1-0.15=0.85mol,转化率为0.85/1=85%,正确。H<0,反应为放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com