
题目列表(包括答案和解析)
3.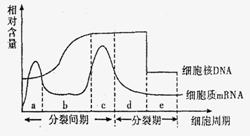 右图为细胞分裂各阶段的细胞核DNA和细胞质中mRNA含量的变化曲线,下列有关说法正确的是
右图为细胞分裂各阶段的细胞核DNA和细胞质中mRNA含量的变化曲线,下列有关说法正确的是
A.c时期合成蛋白质为DNA复制准备了条件
B.c时期mRNA因b时期DNA含量增加而增加
C.诱变育种过程中诱变剂在b时期发挥作用
D.杂交育种中基因重组发生在d时期
2.下列有可能在蓝藻细胞中发生的过程为
①N2→NH3 ②氨基酸→多肽 ③NO→N2
④CO2+H2O→(CH2O)+O2 ⑤NH3→NO ⑥C6H12O6+O2→CO2+H2O
A.①②④⑤⑥ B.③④⑤ C.② D.①②④⑥
1.生物实验中 , 常常通过观察某些化学试剂使细胞结构产生颜色变化或与有机化合物产生颜色反应 , 来获得实验结果。下列叙述错误的是
A.吡罗红甲基绿染色剂可使细胞中的 RNA 呈现红色
B.健那绿染液可使活细胞中的线粒体呈现蓝绿色
C.直接加入重铬酸钾晶体可使密闭培养的酵母菌溶液呈灰绿色
D.改良苯酚品红染液可使细胞中的染色体着色
30.(16分)根据下面人体体液分布及物质交换示意图回答问题:
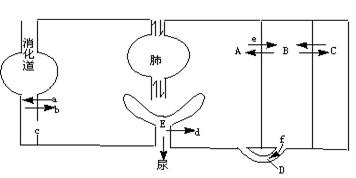
(1)水由消化道进入A,即过程b是以 方式进行的。
(2)人体细胞赖以生存的内环境包括图中的 (只写字母)。其中A中的水以 形式进入消化道。
(3)A中的代谢废物的排出途径除图中表示的外,还应有 。A和B的交换是通过 结构进行的。
(4)过程e和f的渗透方向的不同处在于: 。
(5)过程d表示 作用。
(6)E与A相比,E中特有的成分是 。
选考题(每科选做1题)
29.(24分)回答下列I、II小题
I、(14分)控制狗的皮毛中色素的分布的等位基因有三个,分别是A和a1、a2。A使暗色素在全身均匀分布;等位基因a1降低了色素的沉积程度,产生沙色的狗;等位基因a2产生斑点形式,例如沙色和黑色相间分布。显性的顺序是A>a1>a2。根据下图分析回答:
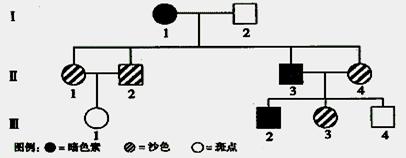
(1)依次写出Ⅰ1、Ⅱ1、Ⅲ1的基因型:___________________。
(2)Ⅱ1和Ⅱ2再生斑点子代概率是_____________;Ⅰ1和Ⅰ2交配产生沙色子代概率是____________。
(3)假设Ⅰ1和Ⅱ3交配,产生的暗色子代中,杂合体的比例为______________。
(4)请用遗传图解说明Ⅱ3和Ⅱ4交配产生后代表现型之比。
Ⅱ、(10分)在一个海岛上;一种海龟中有的脚趾是连趾(ww),有的脚趾是分趾(WW、Ww),连生的脚趾便于划水,游泳能力强,分趾则游泳能力较弱。若开始时,连趾和分趾的基因频率各为0.5,当海龟数量增加到岛上食物不足时,连趾的海龟容易从海水中得到食物,分趾的海龟则不易获得食物而饿死,若干年后,基因频率变化成:W为0.2,w为0.8。请问:
(1)该种群中所有海龟所含的基因称为该种群的____。基因频率变化后,从理论上计算,海龟种群中连趾占整个种群的比例为 。
(2)导致海龟种群的基因频率变化的原因是什么? 。
(3)这种基因频率的改变,是否发生了生物进化?请简述理由。
。
(4)这种基因频率改变,是否产生了新的物种?请简述理由。
。
28.(14分)甘薯和马铃薯都富含淀粉,但甘薯吃起来比马铃薯甜,为探究其原因,某兴趣小组以甘薯和马铃薯块茎为材料,在不同温度、其他条件相同的情况下处理30min后,测定还原糖含量,结果表明马铃薯不含还原糖,甘薯的还原糖含量见下表:
|
处理温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
甘薯还原糖含量 (mg/g) |
22.1 |
23.3 |
25.8 |
37.6 |
40.5 |
47.4 |
54.7 |
68.9 |
45.3 |
28.6 |
(1)由表可见,温度为70℃时甘薯还原糖含量最高,这是因为______________________。
(2)马铃薯不含还原糖的原因是___________________。
(3)为了确认马铃薯不含还原糖的原因,请完成以下实验:
实验原理:①_______________________________________________________;
②_______________________________________________________。
材料与用具:甘薯提取液(去淀粉和还原糖),马铃薯提取液(去淀粉),斐林试剂,质量分数为3%的淀粉溶液,试管等。
实验步骤:
第一步: 。
第二步:70℃水浴保温5min后, 。
第三步:70℃水浴保温5min后,在A、B两支试管中再各加入等量斐林试剂
第四步:沸水浴加热煮沸1-2min
实验结果:A管砖红色,B管蓝色
(4)食用马铃薯后消化分解成的葡萄糖,被小肠上皮细胞吸收后发生的代谢变化是
。
27. (18分)聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料制取聚合硫酸铁,为控制水解时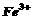 的浓度,防止生成
的浓度,防止生成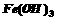 ,原料中的
,原料中的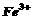 必须先还原为
必须先还原为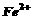 。实验步骤如下:
。实验步骤如下:
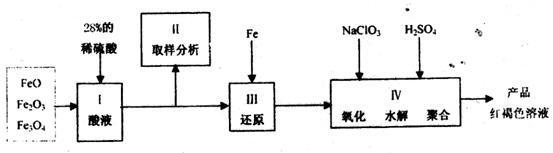
(1)步骤II取样分析溶液中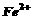 、
、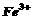 的含量,其目的是
。
的含量,其目的是
。
(2)步骤III完成后溶液中的金属阳离子是 ,可用 试剂检验其存在。
(3)用 氧化时反应如下,请配平该化学方程式:
氧化时反应如下,请配平该化学方程式:
□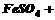 □
□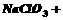 □
□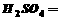 □
□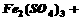 □
□ □
□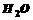
若改用硝酸作氧化剂,有何弊端: 。
(4)聚合硫酸铁溶液中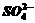 与
与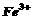 物质的量之比可根据下列提供的试剂和操作方法进行测定,请按要求回答下列问题:
物质的量之比可根据下列提供的试剂和操作方法进行测定,请按要求回答下列问题:
① 所需的试剂是(填选项字母,下同) 。
A.  溶液 B.
溶液 B.
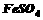 溶液 C.
溶液 C.
 溶液 D.
溶液 D.
 溶液
溶液
② 需要测定其质量的物质化学式是 。
③ 按顺序分别写出测定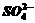 与
与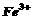 物质的量之比的过程中涉及的基本操作:
物质的量之比的过程中涉及的基本操作:
; 。
A. 萃取、分馏 B. 冷却、称重 C. 蒸发、结晶 D. 过滤、洗涤
E. 添加试剂、充分搅拌 F. 灼烧 G. 烘干
26.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C常温下为无色液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作干电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
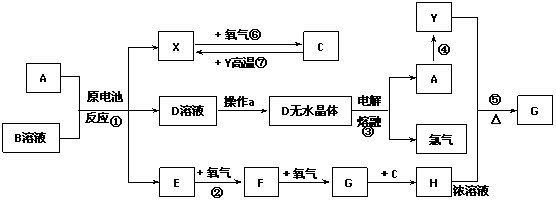
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应①的离子方程式为 。
(5)原电池反应①中正极的电极反应式为 。
25.(15分)
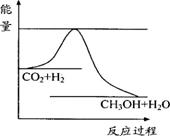 Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为_______________。
(3)温度降低,平衡常数K_________(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。
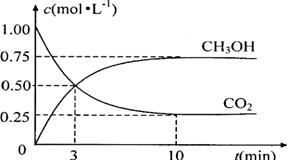
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有______。
A.升高温度; B.加入催化剂; C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2; E.充入He(g),使体系总压强增大。
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12
该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
|
序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
20.00 |
0.00 |
8 |
|
② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为_______ 。
24.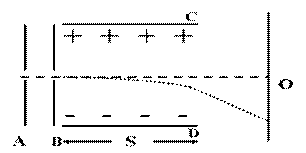 (15分)如图所示AB、CD为平行金属板,A、B两板间电势差为U1=500V,C、D始终和电源相接,测得其间的场强为E=104V/m,一质量为m=2.5×10-24㎏,
(15分)如图所示AB、CD为平行金属板,A、B两板间电势差为U1=500V,C、D始终和电源相接,测得其间的场强为E=104V/m,一质量为m=2.5×10-24㎏,
电荷量q为8×10-16C的带正电粒子(重力不计),
由静止开始,经A、B加速后穿过C、D发生偏转,
最后打在荧光屏上,已知C、D极板长均为S=4cm,
荧光屏距CD右端的距离为L=3cm,问:
(1) 粒子打在荧光屏上距O点下方多远处?
(2)粒子打在荧光屏上时的动能为多大?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com