
题目列表(包括答案和解析)
30.(18分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%。目前我国已经在技术上取得突破――用硫酸渣炼铁。
I.某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验(已知25℃氢氧化镁Ksp=5.6×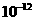 ;氢氧化铁Ksp=3.5×10-38;一水合氨电离常数K=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1)。
;氢氧化铁Ksp=3.5×10-38;一水合氨电离常数K=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1)。
方案一:
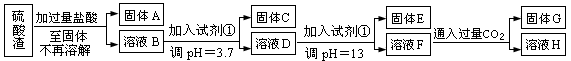
请回答:
(1)写出固体E的化学式:__________________。
(2)试剂①是_____________
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是_________
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(4)溶液H中溶质的化学式:__________________
(5)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操
作为_________________。
(6)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)=__________________。
方案二:
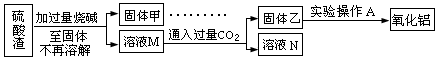
请回答:(7)此方案的主要问题有:____________________________________________
(8)写出由溶液M固体乙这个过程中,最主要化学反应的离子方程式:
_______________________________________________________________
II.为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(1)判断到达滴定终点的现象是___________________________________________。
(2)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL,试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是 。
[选做部分]
共8个题,考生必须从中选择2个物理题、1个化学题和1个生物题在答题卡规定的区域作答。
29.(14分)乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g) + 6H2(g)\s\up8(催化剂催化剂△CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)在一定压强和温度下,在反应物总物质的量相同的情况下,测得该反应的实验数据如下表:

|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 提高氢碳比[n(H2)/n(CO2)],则CO2的转化率___________;化学平衡____________移动,平衡常数K__________(填“增大”、“减小”、或“不变”)。
(3)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧气作用生成水和二氧化碳。该电池的负极反应式为:_____________________________________。
若以上述燃料电池为电源来电解饱和食盐水,当消耗46g乙醇时,电解产生的H2
体积(标况)为_________L。
(4)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式________________________________________________。
28.(10分)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c( )>c( )>c( )>c( )
②当盐酸与氨水等物质的量反应时,溶液的pH_____7(填“>”或“<”或“=” ,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论。
_____________________________________________________________________
_____________________________________________________________________
27.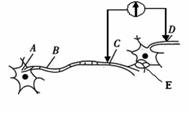 (16分)回答下列有关生物生命活动调节的相关问题:
(16分)回答下列有关生物生命活动调节的相关问题:
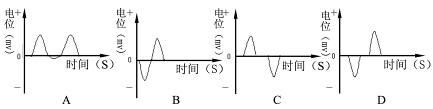
(1)若在右图中C和D两点的细胞膜表面安放电极,中间接记录仪(电流左进右出为+),当信号在神经细胞间传递时,检测到的结果是( )
(2)在外界环境发生剧烈变化的情况下,人体的内环境仍能维持稳态。当环境温度高于38℃时,人体只有通过__________方式散热,该过程的调节方式是以_____________为主。人在炎热环境中大量出汗后,__________细胞产生兴奋,传导至大脑皮层产生渴觉,同时血液中的抗利尿激素___________。
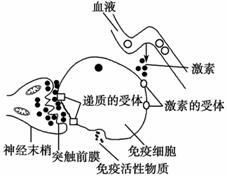 (3)科学研究表明:精神因素(焦虑、紧张等的心理应激)会使T细胞活性下降,对病毒、真菌感染的抵抗能力和对肿瘤细胞的监控能力下降,还间接引起机体生成抗体的能力降低。下图表示神经、免疫、内分泌三大系统相互调节的部分示意图,请据图回答:
(3)科学研究表明:精神因素(焦虑、紧张等的心理应激)会使T细胞活性下降,对病毒、真菌感染的抵抗能力和对肿瘤细胞的监控能力下降,还间接引起机体生成抗体的能力降低。下图表示神经、免疫、内分泌三大系统相互调节的部分示意图,请据图回答:
①精神因素能使T细胞活性下降,导致机体生成抗体能力降低的原因是
______________________________。
②由图可知,神经系统可通过突触前膜 ,直接调节免疫器官或免疫细胞的活动,还可通过有关激素间接调节免疫器官或免疫细胞的活动。
③维持机体稳态离不开细胞间的信息交流,动物细胞间进行信息交流的途径有:一是通过 (至少填两种)等信息分子经体液运输并作用于靶细胞来实现;二是通过细胞间的接触实现信息交流。吞噬细胞将抗原呈递给T细胞是通过 途径实现的。
(4)某同学认为一种植物(X植物)的提取液对SARS病毒有抑制作用,他以小白鼠为研究材料设计了下面的实验进行证明:
实验步骤:
①选择一只健康的小白鼠,让小白鼠感染SARS病毒;
②给喂养小白鼠的饲料中加入一定量的X植物提取液,观察小白鼠是否出现患病症状;
我们认为该同学的实验存在明显的不科学之处,请指出两点:
① ;
② ;
26.(17分) 请回答下列有关遗传问题:
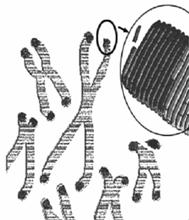 Ⅰ.2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。
Ⅰ.2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。
(1)非同源染色体末端发生错误融合属于染色体结构变异中的_________________,结果使染色体上基因的________________________发生改变。
(2)从功能上看,端粒酶属于_____________________酶。
(3)如果正常体细胞中不存在端粒酶的活性,你认为新复制出的DNA与亲代DNA完全相同吗?____________________________。体外培养正常组织细胞,细胞中端粒长度与细胞增殖能力呈______________(正相关、负相关)关系。
Ⅱ.正常小鼠体内常染色体上的B基因编码胱硫醚γ-裂解酶(G酶),体液中的H2S主要由G酶催化产生。为了研究G酶的功能,现需要选育基因型为B- B-的小鼠。选育时可通过将小鼠一条常染色体上的B基因去除,培育出一只基因型为B+ B- 的雄性小鼠(B+ 表示具有B基因,B- 表示去除了B基因,B+ 和B- 不是显隐性关系)。请回答: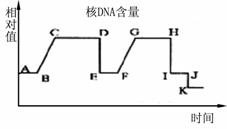
(1)若在右图中A点将核DNA带上同位素标记后放在不含同位素标记的地方培养,则在GH段可检测到有放射性的脱氧核苷酸链占________ ,有放射性的精子所占的比例为__________。
(2)B基因控制G酶的合成,其中翻译过程在细胞质的核糖体上通过tRNA上的___________与mRNA上的相应碱基识别,将氨基酸转移到肽链上。
(3)右图表示不同基因型小鼠血浆中G酶浓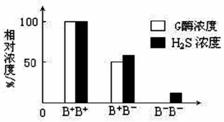 度和H2S浓度的关系。据图描述B+ B+ 和B+ B-个体的基因型、G酶浓度与H2S浓度之间的关系:__________________________________________。B- B-个体的血浆中没有G酶而仍有少量H2S产生,可能的原因是___________________。
度和H2S浓度的关系。据图描述B+ B+ 和B+ B-个体的基因型、G酶浓度与H2S浓度之间的关系:__________________________________________。B- B-个体的血浆中没有G酶而仍有少量H2S产生,可能的原因是___________________。
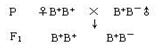 (4)以该B+ B- 雄性小鼠与正常小鼠(B+ B+ )为亲本,进行杂交育种,选育B- B- 雌性小鼠。请将育种过程补充完整。
(4)以该B+ B- 雄性小鼠与正常小鼠(B+ B+ )为亲本,进行杂交育种,选育B- B- 雌性小鼠。请将育种过程补充完整。
第一步:
第二步:(用遗传图解表示,其中表现型不作要求。)
第三步:从子二代雌性小鼠中选出B- B-小鼠,选择的方法是__________________________。
25.(18分)如图,直线MN 上方有平行于纸面且与MN成45°的有界匀强电场,电场强度大小未知;MN下方为方向垂直于纸面向里的有界匀强磁场,磁感应强度大小为B.今从MN 上的O点向磁场中射入一个速度大小为v、方向与MN成45°角的带正电粒子,该粒子在磁场中运动时的轨道半径为R .该粒子从O点出发记为第一次经过直线MN ,第五次经过直线MN时恰好又通过O点.不计粒子的重力.
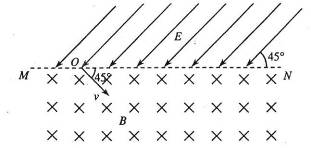 (1) 画出粒子在磁场和电场中运动轨迹的草图;
(1) 画出粒子在磁场和电场中运动轨迹的草图;
(2) 求出电场强度E的大小;
(3)求该粒子再次从O点进入磁场后,运动轨道的半径r;
(4) 求该粒子从O点出发到再次回到O点所需的时间t.
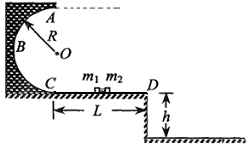
24.(15分)如图所示,半径R=0.5m的光滑半圆轨道竖直固定在高h=O.8m的光滑水平台上并与平台平滑连接,平台CD长L=1.2m.平台上有一用水平轻质细线栓接的完全相同的物块m1和m2组成的装置Q,Q处于静止状态。装置Q中两物块之间有一处于压缩状态的轻质小弹簧(物块与弹簧不栓接).某时刻装置Q中细线断开,待弹簧恢复原长后,m1、m2两物块同时获得大小相等、方向相反的水平速度,m1经半圆轨道的最高点A后,落在水平地面上的M点,m2落在水平地面上的P点. 已知ml= m2 = 0.2kg,不计空气阻力,g取10m/s2.若两物块之间弹簧被压缩时所具有的弹性势能为7.2J,求
(1)物块m1通过平台到达半圆轨道的最高点A时对轨道的压力;
(2)物块m1和m2相继落到水平地面时PM两点之间的水平间距.
23.(12分)请完成以下两小题.
(1)(4分)某同学在应用打点计时器做验证机械能守恒定律实验中,获取一根纸带如图(a),但测量发现0、1两点距离远大于2mm,且0、1和1、2间有点漏打或没有显示出来,而其他点都是清晰完整的.现在该同学用刻度尺分别量出2、3、4、5、6、7六个点到0点的长度h2、h3、h4、h5、h6、h7,再分别计算得到3、4、5、6四个点的速度v3、v4、v5、v6和速度的平方v32、v42、v52、v62 ,已知打点计时器打点周期为T.
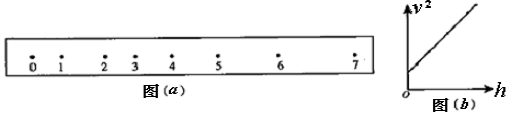 ①该同学求6号点速度的计算式是:v6=
①该同学求6号点速度的计算式是:v6=
②然后该同学将计算得到的四组(hi ,vi2)数据描绘在v2一h坐标系中,并以这四个点作出如图(b)所示的直线,请你回答:他是如何根据图象判断重锤下落过程中机械能守恒的?
____________________________________________________________________
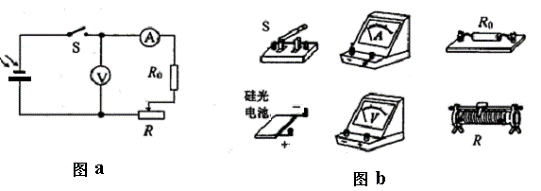
(2)(8分)硅光电池是一种可将光能转化为电能的元件.某同学利用如图a所示电路探究某硅光电池的路端电压U与电流I的关系.图中R0=2Ω,电压表、电流表均可视为理想电表.
①用“笔画线”代替导线,将图b中的器材按图a所示电路连接起来.
②实验一:
用一定强度的光照射硅光电池,闭合电键S,调节可调电阻的阻值,通过测量得到该电池的U-I曲线a(见图c).则由图象可知,当电流小于200 mA时,该硅光电池的电动势为 V,内阻为 Ω.
③实验二:
减小光照强度,重复实验,通过测量得到该电池的U-I曲线b(见图c).
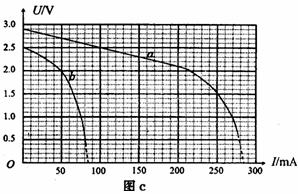
在做实验一时,调整R的阻值使电压表的读数为1.5V;保持R的阻值不变,在实验二的光照强度下,可调电阻R的电功率为 mW(保留两位有效数字).
22.如图所示,物体A、B通过细绳及轻质弹簧连接在轻滑轮两侧,物体A、B的质量分别为m、2m,开始时细绳伸直,用手托着物体A使弹簧处于原长且A与地面的距离为h,物体B静止在地面上.放手后物体A下落,与地面即将接触时速度为v,此时物体B对地面恰好无压力.若在物体A下落的过程中弹簧始终处在弹性限度内,则此时,
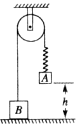 A.物体A的加速度大小为g,方向竖直向下
A.物体A的加速度大小为g,方向竖直向下
B.弹簧的弹性势能等于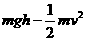
C.物体B处于平衡状态
D.弹簧对A物体拉力的瞬时功率大小为2mgv
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
21.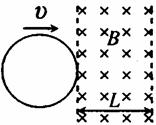 如图所示,两平行虚线之间存在的匀强磁场,磁场方向垂直纸面向里,虚线间的距离为L,金属圆环的直径也是L.圆环以垂直于磁场边界的恒定速度v穿过磁场区域.规定逆时针方向为圆环中感应电流i的正方向,圆环从左边界刚进入磁场处为位移x的起点.则下列图象中能表示圆环中感应电流i随其位移x变化关系的是
如图所示,两平行虚线之间存在的匀强磁场,磁场方向垂直纸面向里,虚线间的距离为L,金属圆环的直径也是L.圆环以垂直于磁场边界的恒定速度v穿过磁场区域.规定逆时针方向为圆环中感应电流i的正方向,圆环从左边界刚进入磁场处为位移x的起点.则下列图象中能表示圆环中感应电流i随其位移x变化关系的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com