
题目列表(包括答案和解析)
13.某元素R的原子核外电子数等于核内中子数,该元素单质7.8g与氧气充分反应可生成13g化合物RO,则该元素位于周期表中
A.第二周期 B.第三周期 C.ⅤA族 D.ⅡA族
12.有Wn+、Xm+、Ym-、Zn-四种离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是七彩教育网
A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大七彩教育网
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ七彩教育网
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质七彩教育网
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强七彩教育网
11.
 二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
A.S2Cl2的电子式为
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,键长:S-Cl < S-Br
D.S2Cl2与H2O反应的化学方程式可能为:2 S2Cl2 + 2 H2O == SO2↑+ 3 S↓+ 4 HCl
10.以下对核外电子运动状况的描述正确的是
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
9.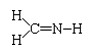 下列化学式对应的结构式从成键情况看不合理的是
下列化学式对应的结构式从成键情况看不合理的是

A.CH3N, B.CH2SeO,
 C.CH4S,
C.CH4S,
 D.CH4Si,
D.CH4Si,
8.前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有几种
A.3种 B.4种 C.5种 D.6种
7.科学家预测原子序数为114的元素,具有相当稳定的同位素,它的位置在第七周期ⅣA族,称为类铅。关于它的性质,预测错误的是
A.它的最外层电子数为4
B.它具有+2、+4价
C.它的金属性比铅强
D.将铜放到114号元素的硝酸盐溶液后,会得到114号元素单质
6.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
5. 据中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相(如图)。它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为“镶嵌冰”。有趣的是,这种镶嵌冰可以在室温下稳定存在。有关这种镶嵌冰的推测肯定不正确的
据中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相(如图)。它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为“镶嵌冰”。有趣的是,这种镶嵌冰可以在室温下稳定存在。有关这种镶嵌冰的推测肯定不正确的
A.液态水变为“镶嵌冰”属物理变化
B.“镶嵌冰”也是水分子间通过氢键结合而成的固体学科
C.“镶嵌冰”中每个水分子形成两个氢键
D.“镶嵌冰”的密度与普通冰的密度可能不相同
4.关于元素周期律和元素周期表的下列说法,正确的是
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com