
题目列表(包括答案和解析)
23. (9分)茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500 g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果.请回答下列问题:
步骤 1中:使茶叶灰化需要三角架、泥三角、酒精喷灯、_________、_________等仪器.
步骤2中:改用试剂________________来调节pH将更为方便.判断沉淀已经洗涤干净的方法是______________________________________________________________.
步骤3中:原茶叶中钙离子的质量分数为________________.若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________(填下列序号之一:①偏小 ②偏大 ③不偏 ④偏小或偏大或不偏)
22.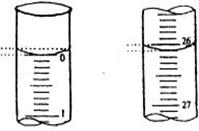 (8分)某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(8分)某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1).配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要的玻璃仪器有_________、___________.
(2).滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到因加入一滴盐酸后,溶液由红色变为无色,并且半分钟内不恢复红色为止.
(3). 读数:若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_________mL,终点读数_____________mL.
(4).数据处理:某学生根据三次实验分别记录有关数据如下:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
|
第三次 |
25.00 |
0.22 |
26.31 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(5).误差讨论:(选填“偏高”、“偏低”或“无影响” )
①.若酸式滴定管尖嘴部分滴定前无气泡,滴定终了有气泡,测得的氢氧化钠溶液的浓度将_________.
②.若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将__________.
21.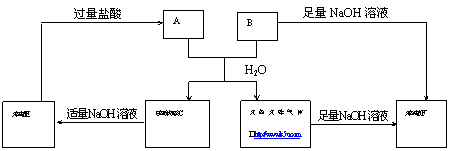 (5分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(5分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1).A和B的混合物溶于水发生反应的离子方程式___________________________________.
(2). B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式_________________________________________________________.
20. (3分)今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Cl-、Cu2+、Fe3+、CO32-、SO42-,现每次取100.00ml进行下列实验:
①. 第一份加入AgNO3溶液有沉淀产生.
②. 第二份加足量NaOH后加热,收集到气体0.896L(标准状态下).
③. 第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩余2.33g.
在原溶液中一定存在的离子及其物质的量浓度分别为: _______________ .
19.(6分)(1).中和pH=3的醋酸(Ka=1.75×10-5)100mL,需要0.1mol/LNaOH溶液的体积为:____________.
(2).在一定体积0.005mol/LBa(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11.假设反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是______________.
18.纸层析法的原理是
A.萃取原理 B.毛细现象 C.蒸馏原理 D.极性相似相溶原理
17.以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)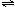 SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32- + SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
16.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述观点,下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.Al4C3的水解产物之一是CH4
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
15.某物质溶液的pH=3,若加水稀释使溶液体积变为原来的10倍,所得溶液的pH: 3<pH<4,则该物质可能是
A.H2S B.HCl C.CH3COONa D.NH4Cl
14. 下列各溶液中,微粒的物质的量浓度关系正确的是()
下列各溶液中,微粒的物质的量浓度关系正确的是()
A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
B.0.2mol/L的Na2CO3溶液中:c(OH-)= c(HCO3-) +c(H+)+2 c(H2CO3)
C.0.1mol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合,其混合溶液中:
c(Cl-) >c(NH4+) > c(Na+)> c(H+)> c(OH-)
H4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:
c[(NH4)2SO4] < c[(NH4)2CO3] < c(NH4Cl)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com