
题目列表(包括答案和解析)
22. (5分)依据氧化还原反应:2Ag+(aq)+Fe(s) =Fe2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题:
(5分)依据氧化还原反应:2Ag+(aq)+Fe(s) =Fe2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极;
X电极上发生的电极反应为 ;
(3)盐桥中的阳离子移动的方向是 (移向X或移向Y)。
21.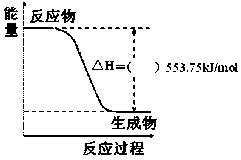 (9分)⑴北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
(9分)⑴北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
① 右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)
过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式
。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放 出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+ O2(g)
O2(g) CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有 。
CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有 。
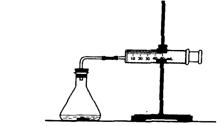
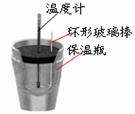
20、(6分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液及如右图的仪器,尚缺少的实验玻璃用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热△H(平均值) |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol·
L-1NaOH |
50mL.0.5mol·
L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol·
L-1NaOH |
50mL.0.5mol·
L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响。
19.
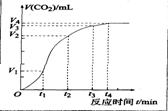 (6分)为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的C02气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
(6分)为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的C02气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
(1)化学反应速率最快的时间段是 ,原因是 ;
A.0~t1 B.t1~t2 C.t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 ;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl
 (3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率ν(HCl)=
mol·L-1·min-1。
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率ν(HCl)=
mol·L-1·min-1。
18.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量:23.15kJ |
|
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
第II卷(非选择题 共46分)
17.一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) 2C(g) △H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
2C(g) △H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
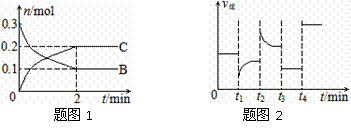
A.反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件可能是升高温度
C.t3时改变的条件可能是加压,此时c(B)不变
D.t4时可能是使用了催化剂,此时c(B)不变
16. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述不正确的是
A.放电时锌做负极 B.充电时电池的正极和电源的正极相连
C.充电时氢氧化铁被氧化 D.放电时每转移3 mol e-,有2 mol FeO42-被还原
15.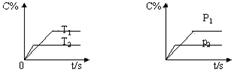 下图表示可逆反应mA(g)+nB(g)
下图表示可逆反应mA(g)+nB(g)  pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
14.被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是
ZnO+2MnO(OH)。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当6.5 g Zn完全溶解时,流经电极的电子0.1mol
D.电池正极反应式为2MnO2+2e-+2H2O 2MnO(OH)+2OH-
2MnO(OH)+2OH-
13.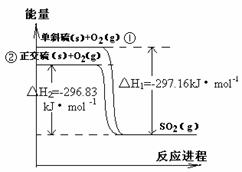 单斜硫和正交硫转化为二氧化硫的能量变化图如右图,
单斜硫和正交硫转化为二氧化硫的能量变化图如右图,
下列说法正确的是
A.S(s,单斜) = S(s,正交) △H = +0.33kJ·mol -1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂lmol O2中的共价键所吸收的能量比
形成1mol SO2中的共价键所放出的能量少297.16kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com