
题目列表(包括答案和解析)
10.已知热化学方程式:H+(aq)+OH-(aq)= H2O (l) △H 1= -57.3 kJ/mol
1/2H2SO4(浓)+ NaOH(aq)= 1/2 Na2SO4(aq)+ H2O (l) △H 2 = m kJ/mol,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子数
B.△H 1 > △H 2
C.△H 2 = -57.3 kJ/mol
D.1/2H2SO4(aq)+1/2 Ba(OH)2(aq)= 1/2 BaSO4(S)+ H2O (l) △H 3 = -57.3 kJ/mol
9.向容积为2L的恒容密闭容器中充人2mol A气体和1mol B气体,在恒温的条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
①用物质A表示该反应的平均反应速率为0.2mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
8.下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
A.HCl+NH3===NH4Cl B.2KClO3===2KCl+3O2↑
C.2Na2O2+2H2O===4NaOH+O2↑ D.Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
7.下列说法或表示正确的是( )
A.等物质的量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多
B.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质B比单质A稳定
C.Zn(s)+ CuSO4(aq)= ZnSO4(aq)+ Cu(s) ΔH=-216 kJ·mol-1,说明
反应物具备的总能量大于生成物具备的总能量
D.在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.5kJ的热量,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
6.从下列事实,找出不能用勒沙特列原理解释的是( )
 A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
 B.对2HI H2+I2(g)
B.对2HI H2+I2(g) 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应CO+NO2 CO2+NO △H <0,升高温度使平衡向逆方向移动
CO2+NO △H <0,升高温度使平衡向逆方向移动
D.合成氨反应:N2+3H2
 2NH3 △H<0,为使氨的产率提高,理论上应采取低温
2NH3 △H<0,为使氨的产率提高,理论上应采取低温
5.恒温恒容下,下列叙述不是可逆反应A(g)+3B(g)
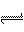 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
(1)C的生成速率是B的生成速率的2/3倍;(2)单位时间生成amolA,同时生成3amolB;
(3)A、B、C的浓度不再变化; (4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化; (6)单位时间消耗amolA,同时生成3amolB;
(7)A、B、C、的分子数目比为1:3:2。
A. (2)(7) B.(6)(4) C.(1)(3) D.(5)(6)
4.在2A(s)+B(g) 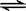 3C(g)+4D(g)中,表示该反应速率最快的是( )
3C(g)+4D(g)中,表示该反应速率最快的是( )
A.υ(A) = 0.9mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=1 mol·L-1·min-1
3.新的替代能源主要包括( )
①核能 ②柴草 ③焦炭④太阳能 ⑤氢能⑥液化石油气⑦水煤气 ⑧天然气
A. ②③⑥⑦ B.①④⑤ C.③⑥⑦⑧ D.①②④
2.下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
1.下列说法不正确的是( )
A.根据ΔH可以判断此反应是放热反应还是吸热反应
B.根据化学反应速率可以判断反应物转变为生成物的难易
C.根据熵变还不可以判断化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的限度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com