
题目列表(包括答案和解析)
12、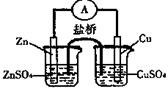 关于右图所示的原电池,下列说法正确的是
关于右图所示的原电池,下列说法正确的是
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是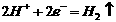
11、下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
10、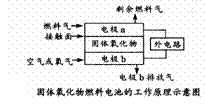 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体燃料电池的有关说法正确的是
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为:
O2 +4e-=2O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,接触面上发生的反应为:
H2 + 2OH- -2e-= 2H2O[
D.若C2H4作为燃料气,接触面上发生的反应为:C2H4 +6O2- -12e-= 2CO2 +2H2O
9、在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则下列说法正确的是
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则下列说法正确的是
A.平衡向正反应方向移动 B.物质A的转化率减小
C.物质B的物质的量减少 D.化学计量数a>b
8、下列事实不能用勒夏特列原理解释的是[
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅
HBr+HBrO,当加入NaOH溶液后,溶液颜色变浅
B.对2HI(g) H2(g)+I2(g)平衡体系,增大压强可使颜色变深
H2(g)+I2(g)平衡体系,增大压强可使颜色变深
C.反应CO+NO2 CO2+NO △H<0,升高温度可使平衡向逆反应方向移动
CO2+NO △H<0,升高温度可使平衡向逆反应方向移动
D.工业合成氨工艺中,采用较高的压强来提高原料的转化率
7、工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2 、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g) 2SO2(g)+O2(g);△H=+196.6 kJ/mol
2SO2(g)+O2(g);△H=+196.6 kJ/mol
B.2SO2(g)
+O2(g)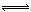 2SO3(g) ;△H=-98.3
kJ/mol
2SO3(g) ;△H=-98.3
kJ/mol
C.SO2(g)+ 1/2O2(g)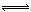 SO3(g);△H=+98.3
kJ/mol
SO3(g);△H=+98.3
kJ/mol
D.SO2(g)+ 1/2O2(g) 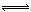 SO3(g);△H=-196.6
kJ/mol
SO3(g);△H=-196.6
kJ/mol
6、当可逆反应2SO2(g)+O2(g) 2SO3(g)到达平衡后,通入18O2气体,再次到达平衡时18O存在于
2SO3(g)到达平衡后,通入18O2气体,再次到达平衡时18O存在于
A.SO2、O2中 B.SO2、SO3中
C.SO3中 D.SO2、SO3、O2中
5、已知450℃时,反应H2(g)+I2(g) 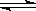 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 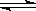 H2(g)+I2(g) 的化学平衡常数为
H2(g)+I2(g) 的化学平衡常数为
A.0.02 B.50 C.100 D.无法确定
4、在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)已达到平衡的是[
2Z(g)已达到平衡的是[
A.单位时间内消耗n mol X同时生成2n mol Z
B.单位时间生成a molX同时生成3a molY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数之比为1∶3∶2
3、反应 2AB(g) =C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH < 0,ΔS > 0 B.ΔH < 0,ΔS <0
C.ΔH > 0,ΔS > 0 D.ΔH > 0,ΔS < 0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com