
题目列表(包括答案和解析)
2.下列各物质命名正确的是( )
A.2-甲基-3-丁烯 B.2,4,5-三甲基己烷
C.2,2-二甲基-3-丙醇 D.4-甲基-2-乙基-1-戊烯
1.分子中所有原子不可能共平面的是( )
A.甲烷 B.乙烯 C.乙炔 D.苯
29.(14分)材料(选修三课本第44页实验2-2):向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
 Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与H2O分子互为等电子体的微粒 (填2种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
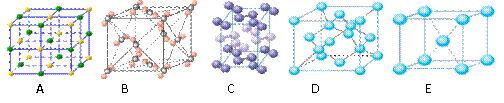
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)。

Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4) 写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5) 实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(6) 实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
|
(1)确定该合金的化学式 ;
(2)若晶体的密度为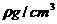 ,则此合金中最近的
,则此合金中最近的
两个Fe原子之间的距离为 cm
(用含 的代数式表示,不必化简);
的代数式表示,不必化简);
(3)取该合金粉末2.78g溶于100mL
某稀硝酸溶液中,待反应完全后
得到1.12L(标准状况)NO气体
(设两者恰发完全反应),则反应后的溶液中含有的金属阳离子有 ;它们的物质的量浓度之比为 。
沈阳二中2009-2010学年度下学期4月月考
28.(10分)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试完成下列问题。
(1)固体A属于________晶体,它的电子式为____________。
(2)A溶于水后,溶液呈___________性(填“酸”“碱”或“中”),其原因是_________________________________(用化学方程式表示)。
(3)A与铜或铜的某些化合物在一定条件下可合成CuH。CuH是一种难溶物,它能与盐酸反应,放出气体,请写出这个反应的化学方程式: _______________________________
27.(8分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
26.(10分)(1)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L,则该温度下水的离子积Kw=___________,t___________25 ℃(填“>”、“<”或“=”),在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为______________________。
(2)将标准状况下的4.48 L氨气完全溶解在含0.1
mol HCl的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是___________________。无论氨水与盐酸以何种比例混合,溶液中始终存在的等量关系是c(NH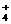 )+c(H+)=_________________________。
)+c(H+)=_________________________。
25.现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中右图所示是已合成的最著名的硫-氮化合物的分子结构。下列说法正确的是
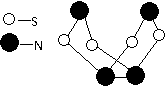 A.该物质的分子式为SN
A.该物质的分子式为SN
B.该物质的分子中既有极性键,又有非极性键
C.该物质在固态时形成原子晶体
D.该物质与化合物S2N2互为同素异形体
第Ⅱ卷 (非选择题,共50分)
24.在密闭容器中发生如下反应:aX(g)+bY(g)
 cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的
cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的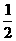 ,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
,当再次达平衡时,W的浓度为原平衡时的1.8倍.下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a+b<c+d
C.z的体积分数增加 D.X的转化率下降
23.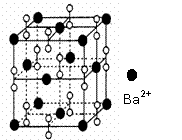 钡在氧气中燃烧时得到一种钡的氧化物晶体,
结构如下图所示,
钡在氧气中燃烧时得到一种钡的氧化物晶体,
结构如下图所示,
有关说法不正确的是
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
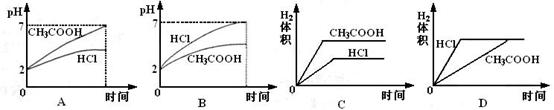
22.在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com