
题目列表(包括答案和解析)
4. 已知4480C反应H2(g)+I2(g)  2HI(g)的平衡常数是49,则1/2H2(g)+
1/2I2(g)
2HI(g)的平衡常数是49,则1/2H2(g)+
1/2I2(g)  HI(g)在该温度下的平衡常数是
( )
HI(g)在该温度下的平衡常数是
( )
A.1/49 B.2401 C. 7 D.1/7
3.250℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是: ( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
2.下列说法正确的是: ( )
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
1、在北京举行的2008年奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号。为了将北京奥运会办成绿色奥运会,下列做法不可取的是 ( )
① 因为油价上涨,所以使用价格较低的含铅汽油
② 开发新能源,减少矿物燃料的燃烧
③ 关闭所有的化工企业
④ 提倡使用一次性发泡塑料餐具和塑料袋
⑤ 开发、生产无汞电池
⑥ 机动车安装尾气净化器
⑦ 为了体现人民生活水平的提高,提倡每个家庭都买小汽车
A.①②③ B.①③④⑦ C.①②④⑤⑥ D.②⑤⑥
31.(7分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子
(1)若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C三种元素的单质熔点由大到小的顺序是 (用化学式表示)。K^S*5U.C#O%
(3)当n=2时,B位于元素周期表的 区,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
福州市八县(市)协作校2009-2010学年第二学期半期联考
30.(13分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:K^S*5U.C#O%
|
a |
|
|
|||||||||||||||
|
|
|
|
|
f |
y |
h |
i |
|
|||||||||
|
|
b |
|
e |
|
|
|
j |
|
|||||||||
|
c |
|
|
|
|
|
|
d |
[ |
d |
|
g |
|
l |
|
|
|
|
|
|
|
|
[ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
(3)请写出e元素的原子价电子轨道表示式 ;
(4)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的原子轨道的杂化类型是 , g2+与ya3 形成的g[ (ya3)4]2+离子的空间构型是四面体形,其中g2+离子提供4个能量最低的空轨道通过杂化与ya3形成 (填化学键类型)。
29.(6分)(1)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请指出图中错误:
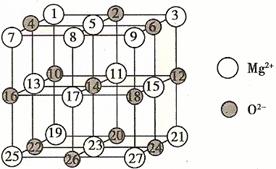
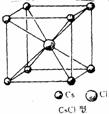
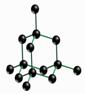
[来源:]
第(1)题图 第(2)题图
(2)如图所示是CsCl、金刚石结构中的某一部分。金刚石中C原子和C-C键数目比为 ,晶体中最小的碳环包含有 个C原子;CsCl晶体中每个铯离子周围与它最接近且距离相等的铯离子有 个,每个铯离子与
个氯离子紧邻
28.(10分)卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I),请预测下列物质的性质:
(1)熔点: F2 Cl2(填“<”或“=”“或>”,下同),沸点:HF HCl,一定压强下HF和HCl的混合气体降温时 (填HF或HCl)先液化。K^S*5U.C#O%
(2)分解温度:HF HCl,熔点:NaF SiF4
27.(10分)(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B的元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是

(4)N≡N的键能为942kJ·mol-1,N-N单键的键能为247kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为
26.(4分) 现有下列物质, 请用字母填空:
A.干冰 B.金刚石 C.氦 D.晶体硅 E.过氧化钠 F.二氧化硅 G.氯化铵
(1)属于原子晶体的化合物是 ,
(2)固态时不含化学键的分子晶体是

(3)含有非极性键的离子化合物是 。
(4)含有离子键、共价键、配位键的化合物是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com