
题目列表(包括答案和解析)
6、常温下,下列有关叙述正确的是k*s*5*u
A.NaB溶液的pH=4,c(Na+)-c(B-)=9.9×10-7 mol·L-1
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③[
D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V (总)=20mL
5、下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
4、以惰性电极电解 CuSO4溶液。若阳极上产生气体的物质的量为 0.0100 mol , 则阴极析出 Cu 的质量为
A.0.64g B.1.28g C.2.56g D.5.12g
3、已知:C(s)+CO2(g) 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
2、在下列各说法中,正确的是
A.对于2SO2(g)+O2(g)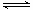 2SO3(g),△H=-QkJ/mol,(Q>0)若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是
2SO3(g),△H=-QkJ/mol,(Q>0)若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是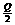 kJ
B.热化学方程式中的化学计量数表示物质的量,不能是分数
C.电镀时,镀件作阴极,含有镀层金属阳离子的溶液作电镀液
D.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
kJ
B.热化学方程式中的化学计量数表示物质的量,不能是分数
C.电镀时,镀件作阴极,含有镀层金属阳离子的溶液作电镀液
D.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
1、下列过程或现象与盐类水解无关的是
A 纯碱溶液去油污 B 铁在潮湿的环境下生锈
C 加热氯化铁溶液颜色变深 D 浓硫化钠溶液有臭味
27.少量的碘化物可利用“化学放大”反应进行测定,其步骤如下:在中性或弱酸性介质中先用Br2将试样中I-定量氧化成碘酸盐,煮沸除去过量的Br2,然后加入过量的KI,用CCl4萃取生成的I2(萃取率E==100%)。分去水相后,用肼(即联氨)的水溶液将I2反萃取至水相(H2N·NH2+2I2==4I-+N2+4H+)。再用过量的Br2氧化,除去剩余Br2后加入过量KI,
酸化,淀粉作指示剂,用Na2S2O3标准溶液滴定(2 Na2S2O3十I2==2NaI+Na2S4O6),求得I-的含量。
(1)请写出Br2将试样中I-定量氧化成碘酸盐的反应方程式;
(2)根据有关反应的化学计量关系,说明经上述步骤后,试样中1 mol的I-可消耗几mol Na2S2O3?相当于“放大”到多少倍?
(3)若在测定时,准确移取含KI的试液25.00mL,终点时耗用0.100mol/L Na2S2O3 20.06mL,请计算试液中KI的含量(g/L),Mr(KI)=166。*k*s*5u
26.(4分)向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,生成了沉淀。如果溶液中C(Ag+)和C(Cl-)的乘积是一个常数,C(Ag+)· C(Cl-)=1.0×10-10,当溶液中C(Ag+)· C(Cl-)>常数,则有沉淀产生,反之沉淀溶解,求
(1)沉淀生成后溶液中C(Ag+)是多少?
(2)如果向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,是否产生沉淀,为什么?*k*s*5u
附加题(5分)
25.(6分)如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
(1)A、B两池中阳极上各产生什么气体?写出电极反应式,并计算标准状况下气体各为多少升?
(2)电解后,A、B两池中pH值各为多少?(设溶液体积不变,也不考虑溶液的水解)
24.(14分)某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:*k*s*5u
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com