
题目列表(包括答案和解析)
3.把下列四种X溶液分别加入四个盛有10ml2mol/L盐酸的烧杯中,均加水稀释到50ml ,此时X与盐酸进行反应,其中反应速率最大的为 ( )
A 20ml3mol/L的X溶液 B.20ml2mol/L的X溶液
C. 10ml4mol/L的X溶液 D .10ml2mol/L的X溶液
2.四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)= 0.15mol/(L·s)②v(B)= 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s)
④v(D)= 0.45mol/(L·s)。其中,反应进行得最快的是 ( )
A.① B.② C.③ D.④
1.下列物质分类组合正确的是 ( )
|
|
A |
B |
C |
D |
|
强电解质 |
HCl |
FeCl3 |
H3PO4 |
Ca(OH)2 |
|
弱电解质 |
HF |
HCOOH |
BaSO4 |
HCl |
|
非电解质 |
NH3 |
Cu |
H2O |
C2H5OH |
31、某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示 :
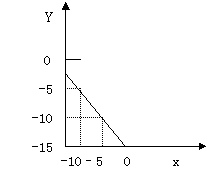 (1) 求该温度下,中性溶液的pH。
(1) 求该温度下,中性溶液的pH。
(2) 求该温度下0.01mol/LNaOH溶液的PH
(3)该温度下,pH=a的醋酸溶液与pH=b的
NaOH溶液等体积混合,恰好完全反应,
求此醋酸溶液中醋酸的电离度。
温州二中2009学年第二学期期中考试
28、Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
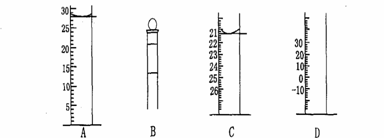
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L-1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。
在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。 甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2
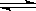 Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是___________、___________。
27、(6分)T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+b B(g) 3C(g)+2D(g),
3C(g)+2D(g),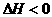 ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=_________,化学方程式中计量数b=________。
(2)乙容器中反应达到平衡所需时间t_________4min(填“大于”、“小于”或“等于”),
原因是___________________________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为
26、(7分)请按要求完成下列反应的式子。
(1)银锌纽扣电池(总反应:Ag2O+Zn= 2Ag+ZnO,电解质溶液:氢氧化钾)的正极反应:______________________________________________________
(2) 电解以下溶液:
A. 当电解质溶液为硝酸银溶液、阳极材料为银、阴极材料为铜的阳极反应:______________________________________________________
B. 当电解质溶液为氯化钠溶液、阳极阴极材料均为石墨的阴极反应:
______________________________________________________
C. 将A中的阳极材料改为石墨,其它条件不变时的电解总反应:
______________________________________________________
(3)请你任选一种离子,这种离子既能电离又能水解,分别写出其电离与水解的离子方程式:
电离:______________________________________________________
水解:______________________________________________________
(4)已知每分解1g NH4NO3晶体放出0.53 kJ(298K,101KPa)热量,同时生成笑气(N2O)与液体水。请根据上述信息写出NH4NO3晶体分解的热化学方程式:______________________________________________________
25、(14分)我国规定饮用水质量标准必须符合下表所示要求:
|
项目 |
pH |
Ca2+、Mg2+总浓度 |
细菌个数 |
|
相关值 |
6.5-8.5 |
<0.0045mol·L-1 |
<100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。
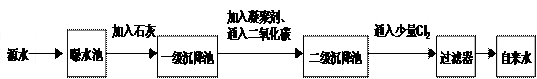
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为 和 ( 写化学式 )。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程 __________(填写编号)。
①只是物理过程; ②只是化学过程; ③是物理和化学过程。
(3)通入二氧化碳的目的是 和调节pH值。
(4)Cl2的作用是 ,这种作用是基于Cl2和水反应的产物具有 性,Cl2与水反应的化学方程式为
(5)下列物质中, 可以作为气体Cl2的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
24、(5分) 化学对人体健康有着十分重要的作用。
(1)为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如右图:加碘食盐中碘的存在形式主要是__________(填序号);
A.I B.I2 C.KI D.KIO3
甲状腺素的分子式为____________。
(2) 某同学到了傍晚时就看不见东西,患了夜盲症,可能的原因之一是他体内缺乏_________,另一同学在刷牙时牙龈经常出血,他可能缺乏_____________,应多吃____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com