
题目列表(包括答案和解析)
4.下列各组离子,在指定的环境中能大量共存的是
A.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
B.在中性溶液中:Al3+、K+、SO42-、HCO3-
C.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-
D.在酸性溶液中:Na+、K+、MnO4-、SO32-
3. 下列变化过程中,△S<0的是
A.氯化钠溶于水 B.NH3(g)与HCl(g)反应生成NH4Cl(s)
C.干冰(CO2)的升华 D.CaCO3(s)分解为CaO(s)和CO2(g)
2. 符合下列条件的化学反应肯定是自发的是
A.△H<0,△S<0 B.△H<0,△S>0
C.△H>0,△S>0 D.△H>0,△S<0
1. 下列反应属于氧化还原反应,而且△H>0的是
 A.灼热的炭与CO2反应
B.Ba(OH)2·8H2O与NH4Cl的反应
A.灼热的炭与CO2反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀H2SO4反应 D.甲烷在O2中的燃烧反应
23.(12分)T℃时,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+b B(g)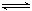 3C(g)+D(g),
3C(g)+D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为0.6mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.4mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为0.6mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.4mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率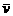 (B)=_________
,化学方程式中计量数b=___ _。
(B)=_________
,化学方程式中计量数b=___ _。
(2)乙容器中反应达到平衡所需时间t_______4min(填“大于”、“小于”或“等于”),原因是____________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,向丙容器中加入C、D的物质的量分别为3mol、1mol,为了达到平衡时B的浓度仍然为0.4mol/L,则还需加入A、B的物质的量分别是___________、___________。
江苏省新海高级中学2009-2010学年度第二学期期中考试
22.(10分)高炉炼铁中发生的基本反应之一如下:
FeO(s)+CO(g) 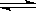 Fe(s)+CO2(g) △H<0
Fe(s)+CO2(g) △H<0
其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时K=0.263。
(1)降低温度,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_________(选填:“增大”、“减小”或“不变”),平衡常数K值_________(选填:“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0.03 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态___ _(选填“是”或“否”),此时,化学反应速率是υ正_______υ逆(选填:“大于”、“小于”或“等于”)。
(3)反应FeO(s)+C(s)==Fe(s)+CO(g) △H>0,ΔS>0,下列说法正确的是_____
A.低温下自发进行,高温下非自发进行
B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行
D.任何温度下均为自发进行
21.(12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
(1)取10.00 mL密度为dg/mL的过氧化氢溶液,稀释至250 mL后,取出25.00 mL溶液至锥形瓶中,加入稀硫酸酸化,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在横线上。
____MnO4- +____H2O2+____H+ ____Mn2++____H2O+___ ______
____Mn2++____H2O+___ ______
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_____________________________________
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
20.(14分)㈠在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB zC
zC
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是
;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向
方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是 (填状态);
(4) 若加热后,C的百分含量减小,则正反应是________热反应。
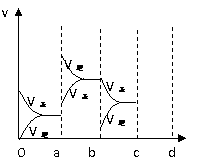 ㈡右图表示在密闭容器中反应:
㈡右图表示在密闭容器中反应:
2SO2+O2 2SO3,△H <0;达到平衡时,
2SO3,△H <0;达到平衡时,
由于条件改变而引起反应速率和化学平衡的变化情况,
⑴a b过程中改变的条件可能是 ;
⑵b c过程中改变的条件可能是 ;
⑶若增大压强时,反应速率变化情况画在c-d处。
19.(10分)(1)Na2S的水溶液呈 (填“酸”、“中”、“碱”)性,原因是
(用离子方程式表示): 。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(2)氯化铝水溶液呈 (填“酸”、“中”、“碱”)性 ,原因是(用离子方程式表示) ___ _ 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
18.如图所示,向A中充入2 mol X和2 mol Y,向B中充入1 mol X和1mol Y,
起始VA=VB= a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:
X(g)+Y(g)  2Z(g)+W(g) △H>0;达到平衡时,Vb=1.2a L,则下列说法正确的是
2Z(g)+W(g) △H>0;达到平衡时,Vb=1.2a L,则下列说法正确的是

① 反应开始时,A容器中化学反应速率快
② B容器中X的转化率为40%,且比A容器中X的转化率大
③ 打开K达新平衡后,B容器体积为2.6aL
④ 打开K,同时升高A、B的温度,达新平衡后,B的体积变大
A.①②③ B. ①②③④ C.② ④ D.只有④
高二年级化学试卷(选修)
第II卷(共58分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com