
题目列表(包括答案和解析)
7.25℃时,pH=a的氨水与pH =b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
A. 10(12-a-b)% B.10(a+b-14)% C. 10(a+b-12)% D.10(14-a-b)%
6.下列事实能说明醋酸属于弱电解质的是
①中和10mL1mol/L CH3COOH溶液需要10mL1mol/LNaOH溶液
②盐酸与醋酸溶液物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01mol/L醋酸溶液的pH大于2
④0.1mol/L CH3COONa溶液显碱性
A.①②③ B.②③④ C.①③④ D.①④
5. 一定温度下容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) 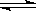 C(g)+D(g)。当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
C(g)+D(g)。当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
①混合气体的密度 ②容器内气体的压强
③混合气体的总物质的量 ④B物质的量浓度:
A.①和④ B.②和④ C.②③④ D.只有④
4.下列说法不正确的是
A.活化分子具有比普通分子更高的能量
B.参加反应的物质的性质是决定化学反应速率的重要因素
C.反应物分子(或离子)间的每次碰撞是反应的先决条件
D.增大反应物浓度,可增大活化分子的百分数,所以反应速率加快
3. 下列电离方程式书写不正确的是:
下列电离方程式书写不正确的是:

 A.2H2O H3O++OH-
B.H2S H++HS-
A.2H2O H3O++OH-
B.H2S H++HS-

 C.NaHS Na++HS-
D.HCO3-+H2O H3O++CO32-
C.NaHS Na++HS-
D.HCO3-+H2O H3O++CO32-
2.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
1.下列说法正确的是:
A.食物在常温下腐败是自发进行的
B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应
D.电解池的反应是属于自发反应
25.(6分) 实验测得每1克碳充分燃烧生成CO2气体放出32.79kJ的热量。试计算含碳90%的8吨煤充分燃烧生成CO2气体时放出多少kJ的热量?
兴化市戴南中学2009-2010学年度第二学期
24.(6分)(1)2H2(气)+O2(气)==2H2O(气);△H =-484kJ/mol
2H2(气)+O2(气)==2H2O(液);△H =-572kJ/mol
若在标准状况下,将H2和O2组成的混和气体点燃烧爆炸后,再恢复到标准状况,气体体积减少33.6升,则反应放出的热量是___ ___kJ。
(2)4克硫粉完全燃烧时放出37千焦热量,该反应的热化学方程式是
____________ _____________。
23.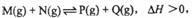 (9分)已知可逆反应:请回答下列问题:
(9分)已知可逆反应:请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1,c(N)= a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(3)若反应温度不变,反应物的起始浓度为:c(M)= c(N)= b mol·L-1,达到平衡后,M的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com