
题目列表(包括答案和解析)
1摩尔物质的质量,就是该物质的摩尔质量,单位是g/mol 。1mol任何物质均含有阿伏加德罗常数个粒子,但由于不同粒子的质量不同,因此,1 mol不同物质的质量也不同;12C的相对原子质量为12,而12 g 12C所含的碳原子为阿伏加德罗常数,即1 mol 12C的质量为12g。同理可推出1 mol其他物质的质量。
注意:摩尔质量是指1摩尔物质(分子、离
子等)的质量,其单位是g/mol或kg/mol等,仅当指明单位为g/mol时,其数值才与该物质的式量相等。
有关关系式:n =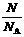 ;n =
;n =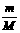
[考点破解]
3.明确物质的量(n)、摩尔(mol)、物质的量的基准(NA)等概念的区别、联系:
⑴“物质的量”和“质量”、“长度”、“时间”、“电流强度”、“热力学温度”、“发光强度”等一样,是七个基本物理量之一,是一个整体名词,“物质的量”四个字不得简化或增添或改变任何字。
⑵物质的量是用来计量原子、分子、离子或一些特定组合等粒子的一种基本物理量
⑶物质的量用摩尔(mol)作单位
⑷0.012kg12C所含的碳原子数目就是阿伏加德罗常数(NA),近似值为6.02×1023
⑸1mol任何粒子所含的粒子数就是阿伏加德罗常数
⑹粒子数=物质的量(mol)×6.02×1023(mol-1)
2.物质的量的基准(NA):以0.012kg12C所含的碳原子数即阿伏加德罗常数作为物质的量的基准。阿伏加德罗常数可以表示为NA,其近似值为6.02×1023 mol-1
1.物质的量(n)是七个基本物理量之一,其意义是表示含有一定量数目的粒子的集体。符号为:n ,单位为:摩尔(mol)。
21.(8分)异丁苯丙酸是高效消炎药芬必得的主要成分,其结构简式为:
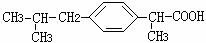
(1)由异丁苯丙酸的结构简式推测,它可能 (填代号)
A.可与Br2发生加成反应而使溴水褪色 B.可与Na2CO3溶液作用生成CO2
C.可使酸性高锰酸钾溶液褪色 D.与银氨溶液发生银镜反应
异丁苯丙酸的一种同分异构体A,在一定条件下可发生下列反应可生成有机玻璃:
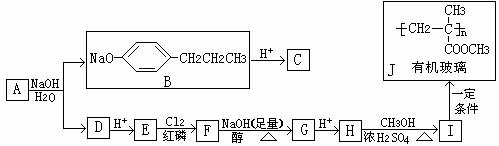
提示: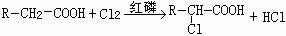
根据以上信息,回答(2)-(5)小题:
(2)写出有机物E、G的结构简式:E 、G 。
(3)写出反应E→F和反应I→J的反应类型:E→F: 反应、I→J: 反应。
(4)写出F→G、H→I的化学反应方程式(注明反应条件,有机物要写结构简式):
F→G: ;H→I: 。
(5)与有机物C具有相同的分子式,且苯环上只有一个取代基的有机物共有
种
20.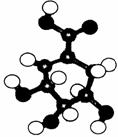 (10分)相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如右图所示。
(10分)相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如右图所示。
请回答下列问题:
(1)M的结构简式是 。
(2)下列关于M的说法,正确的是
A.遇FeCl3溶液呈紫色 B.遇紫色石蕊溶液变红色
C.遇溴水发生取代反应 D.能缩聚为高分子化合物
(3)M在一定条件下发生消去反应,生成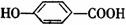 ,试写出该反应的化学方
,试写出该反应的化学方
程式 。
(4)M与有机物A在一定条件下可生成一种相对分子质量为202的酯类物质。A可能的
结构简式是 。
(5)研究发现,有一种物质B的分子组成和M完全一样,但分子中无环状结构;B在
一定条件下水解能够产生甲醇;B的核磁共振氢谱如下图(两个峰面积比为2:3)
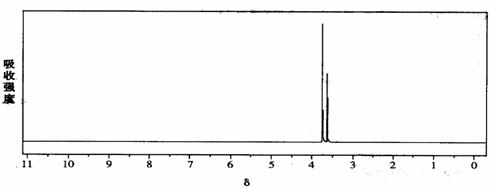
物质B的结构简式是: 。
19.(6分)请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材
料,其晶体结构与单晶硅相似。Ga原子的价电子排布式为 。在GaN晶体
中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的
空间构型为
。在四大晶体类型中,GaN属于 晶体
(3)在极性分子NCl3中,N原子的化合价为-3价,Cl原子的化合价为+1,请推测NCl3
水解的主要产物 (填化学式)。
18.(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素
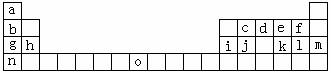
试回答下列问题:
(1)请写出元素O的基态原子电子排布式: 。
(2)d的氢化物的分子构型为 ;中心原子的杂化形式为 ;k
在空气中燃烧产物的分子构型为 ;中心原子的杂化形式为 ;
该分子是 (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如右
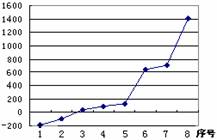 图所示,其中序号“8”代表
(填元素符
图所示,其中序号“8”代表
(填元素符
号);其中电负性最大的是 (填右图中
的序号)。
(4)由j原子跟c原子以1 : 1相互交替结合而形成
的晶体,晶型与晶体j相同。两者相比熔点更
高的是 (填化学式),试从结构角度加以解释:
。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间
相互位置关系的平面图如下图丙所示。
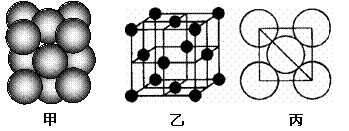
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
① 晶胞中i原子的配位数为___ ___ _ ,一个晶胞中i原子的数目为_ _;
② 该晶体的密度为______ _ (用字母表示)。 K^S*5U.C#
17.(10分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制减法”两种工艺。请按要求回答下列问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
。
(2)写出“联合制减法”有关反应的化学方程式: ; 。
(3)CO2是制碱工业的重要原料,“联合制减法”和“氨碱法”中CO2的来源有何不同?
。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制减法”的总反应,
列出计算原子利用率的表达式:原子利用率(%)= 。
16.(7分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程
由甲苯氧化制备苯甲醛。
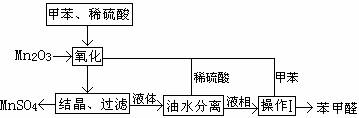
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断的搅拌,搅拌的作用是 。
(2)甲苯经氧化后的得到的混合物通过结晶、过滤进行分离。该过程需要将混合物冷却,
其目的是 。 K^S*5U.C#
(3)实验过程中,可循环使用的物质分别为 、 。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ的名称是 ,其原理是 。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)
|
反应时间/h |
1 |
2 |
3 |
4 |
5 |
|
苯甲醛产率/% |
76.0 |
87.5 |
83.6 |
72.5 |
64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com