
题目列表(包括答案和解析)
20、某同学设计测定镀锌铁皮镀锌层厚度的实验方案:将单侧面积为S、质量为m1的镀锌
铁皮放入6mol·L-1的盐酸中,当气泡产生的速率显著减少时,取出铁片,用水冲洗,烘
干后称量,得到质量为m2,下列说法不正确的是
A.当铁片产生气泡速度减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续和残留的盐酸反应,导致结果偏高
B.实验过程中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果
C.锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌
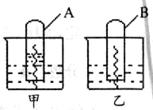 D.设锌镀层厚度为h,锌的密度为
D.设锌镀层厚度为h,锌的密度为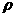 ,那么
,那么
19、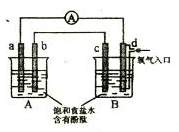 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知
化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知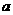 为石墨电极;
为石墨电极;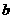 为铁电极;
为铁电极;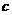 为铝电极(已除去表面氧化膜);
为铝电极(已除去表面氧化膜);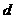 为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是
为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是
A.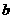 为负极,
为负极,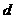 为阳极
为阳极
B.一段时间后,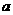 和
和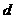 电极附近溶液变红
电极附近溶液变红
C.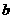 电极电极反应式为:2Cl-2e-=Cl2↑
电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止
实验,再将A中溶液倒入B中混合,充分振荡,
沉淀全部消失
18、常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
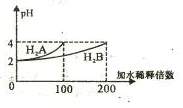 B.稀释前c(H2B)>c(H2A)=0.01mol /L
B.稀释前c(H2B)>c(H2A)=0.01mol /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
17、以石墨作阴极,铜作阳极电解饱和NaCl溶液,电解开始约30s,阳极附近略显白色浑浊,然后开始出现橙黄色浑浊,进而生成较多的橙黄色沉淀。下列说法正确的是
A.阳极:Cu – 2e- = Cu2+ B.水被电解后析出白色浑浊物NaCl
C.橙黄色浑浊是CuCl D.橙黄色沉淀可以用氨水溶解
16、下列反应中无配合物生成的是
A.铝与氢氧化钠反应
B.向氯化铝溶液中加入过量氨水
C.含氟牙膏中加入氯化铝并不断充分搅拌
D.向硫酸铜溶液中通入过量氨气
15、你认为下列数据可信的是
A.某溶液中溶质的质量分数超过100% B.某常见气体的密度为1.8g/cm3
C.某澄清石灰水的浓度是2.0mol/L D.某元素的原子半径是0.160nm
14、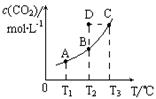 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
下列说法错误的是
A.反应CO(g)+H2O(g)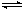 CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
B.在T2时,若反应进行到状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
13、可逆反应:3A(g) 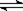 3B(?) + C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体 ②B和C一定都是气体 ③若C是固体,则B一定是气体 ④B和C可能都是气体
3B(?) + C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体 ②B和C一定都是气体 ③若C是固体,则B一定是气体 ④B和C可能都是气体
A、①② B、②③ C、③④ D、①④
12、在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:
 2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
11、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向
盐酸中加入适量的
A.CaCO3(s) B.Na2SO4溶液 C.KNO3溶液 D.CuSO4(s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com