
题目列表(包括答案和解析)
35、某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1-2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) ;
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是 ;
(4)判断到达滴定终点的实验现象是 ;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结
果产生的影响是 。
34、(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7 (填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验
室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的
浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
33、现有以下物质:①NaCl晶体;②液态SO3;③纯醋酸;④汞;⑤BaSO4固体;⑥纯蔗糖;⑦酒精;⑧
熔化的KNO3;请回答下列问题:
(1)以上物质能导电的是 ;(2)以上物质属于电解质的是 ;
(3)以上物质属于非电解质的是 ;以上物质中溶于水后形成的溶液能导电的是
。
32、将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均
未改变的是( )
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
31、类似于水的离子积,难溶盐AmBn也有离子积Ksp=[c (An+)]m·[c (Bm-)]n,已知常温下BaSO4的溶解度为2.33×10-4g,则其Ksp为 ( )
A.2.33×10-4 B.1×10-5 C.1×10-10 D.1×10-12?
30、在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时 ( )
A.c(Ba2+)=c(SO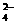 )
)
B.c(Ba2+)=c(SO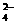 )=[Ksp
(BaSO4)]1/2
)=[Ksp
(BaSO4)]1/2
C.c(Ba2+)≠c(SO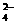 ),c(Ba2+)·c (SO
),c(Ba2+)·c (SO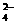 )=Ksp
(BaSO4)
)=Ksp
(BaSO4)
D.c(Ba2+)≠c(SO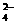 ),c(Ba2+)·c(SO
),c(Ba2+)·c(SO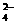 )≠Ksp(BaSO4)
)≠Ksp(BaSO4)
29、医院里用HgCl2的稀溶液作手术刀的消毒剂。HgCl2熔融时不导电,熔点低。HgS难溶于水和稀的强酸却易溶于饱和的NaCl溶液中。关于HgCl2的描述合理的是 ( )
A.是难溶的共价化合物 B.是离子化合物
C.是一种强电解质 D.是一种弱电解质
28、向AgCl饱和溶液中加水,下列叙述正确的是 ( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.AgCl的Ksp增大 D.AgCl的溶解度、Ksp均增大
27、已知常温下反应①、②、③的平衡常数关系为 K1> K3> K2,据此所做的以下推测合理的是
①NH3+H+ NH4+ (平衡常数为K1)
②Ag++Cl-
NH4+ (平衡常数为K1)
②Ag++Cl- AgCl(平衡常数为K2)
AgCl(平衡常数为K2)
③Ag++2NH3 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3)
A.氯化银可溶于氨水 B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸没有白色沉淀 D.银氨溶液可在酸性条件下稳定存在
26、某酸性溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法正确的是( )
A.该溶液可由等物质的量浓度、等体积的HCl溶液和NH3·H2O溶液混合而成该溶液
B.可由pH=3的HCl与pH=11的NH3·H2O溶液等体积混合而成
C.若溶液中离子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-) 溶液中溶质一定只有NH4Cl
D.加入适量NH3·H2O,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com