
题目列表(包括答案和解析)
5.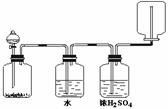 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A.浓硫酸和乙醇反应制备乙烯
B.浓盐酸和二氧化锰反应制备氯气
C.碳酸钙和盐酸反应制备二氧化碳
D.锌和盐酸反应制备氢气
4.已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
3.下列反应:①Na + H2O,②NaH + H2O,③NO2 + H2O,④Cl2 + H2O,⑤IBr + H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是
A.①③ B.②⑤ C.③④ D.④⑤
2.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列对有关实验事实的解释正确的是
A.溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
B.用惰性电极电解相同浓度的Cu(NO3)2和AgNO3混合溶液,阴极首先析出的是Ag,说明Ag+ 的还原性比Cu2+ 强
C.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
D.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
1.自然环境与人们的生活息息相关。下列有关环境的说法不正确的是
A.氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.废旧电池的回收,其主要目的是为了保护环境,而不是回收金属
D.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
29.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
⑴Y、Z、W的原子半径由小到大的顺序是 。
⑵ZW2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体。
⑶工业生产单质Y的原理是(用化学方程式表示) 。
⑷X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
⑸0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_______比 。
28.下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
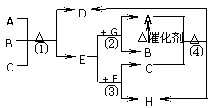 请回答下列问题:
请回答下列问题:
⑴写出D的化学式 。
⑵写出反应①的离子方程式
③的离子方程式
⑶在反应①中每生成1molE,转移电子数为 mol。
27.有A、B、C、D四种电解质,它们均由多种元素组成(元素的原子序数均小于20),相同浓度溶液的pH值是A<B<C<D,且只有A的pH小于7,四种物质的焰色反应皆显黄色,A与B、C、D都能反应,但仅与B、C反应产生无色无味的气体。向A溶液中加入Ba(NO3)2溶液,能产生不溶于硝酸的白色沉淀。试推断A、B、C、D的化学式并写出B和D反应的离子方程式。
⑴A: B: C: D:
⑵B和D反应的离子方程式为:
26.将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
⑴第二个离子反应的离子方程式是
⑵最后一个离子反应的离子方程式是
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平
的该反应的化学方程式: 。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为: 。
25.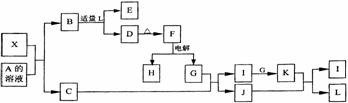 1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是无色气体,D为自色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
⑴写出X的化学式:_______,X属于______晶体(填“原子”、“分子”或“离子”)。
⑵写出X与A溶液反应的化学方程式:
写出常温下H与L反应的离子方程式: 。
⑶X与SiC的复合粉末是新一代人规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
(
)+2N2 4X+SiC+3C。
4X+SiC+3C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com