
题目列表(包括答案和解析)
2.下列变化:①导电、②爆炸、③缓慢氧化、④变化、⑤无水硫酸铜吸水、⑥工业制氧气、⑦石墨变成金刚石、⑧久置苯酚粉红,一定属于化学变化的是 ( )
)
A.①④ B.⑥⑧ C.②⑥⑦ D.③⑤⑦⑧
1.对于只含有一种元素的物质 ( )
A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物
C.一定是纯净物 D.一定是一种单质
23.(12分)已知可逆反应CO(g)+H2O(g)  CO2(g) + H2(g),
CO2(g) + H2(g),
(1)写出该反应的化学平衡常数表达式:K= 。
(2)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(3)830K时,若只将起始时C(H2O)改为6mol/L,则水蒸气的转化率为 。
(4)若830K时,起始浓度 C(CO) = a mol/L,C(H2O) = b mol/L,H2的平衡浓度为
C(H2) = c mol/L,则:
①a、b、c之间的关系式是 ;②当a=b时,a= c。
长乐高级中学高二《化学反应原理》期末练习A
22.(6分)钢铁工业是国家工业的基础。请回答钢铁冶炼.腐蚀.防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式__________________________ 。
(3)下列哪个装置可防止铁棒被腐蚀_____________ 。
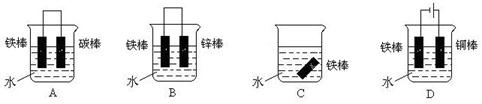 (4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
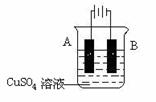 请回答:
请回答:
①A电极对应的金属是 (写元素名称),
B电极的电极反应式是 。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,
请简要说明原因:
。
21.(12分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的无水Na2CO3配成标准溶液进行滴定。具体操作是:称取Wg无水Na2CO3装入锥形瓶中,加适量蒸馏水溶液,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响其pH,为准确起见,滴定终点宜选择在PH4-5之间,则在中学学过的几种指示剂中应选 ,当
,即表示达滴定终点。
(2)若滴到终点时,中和wgNa2CO3,消耗盐酸VmL,则盐酸的物质的量浓度为 mol·L-1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为 c1mol·L-1,用不纯的Na2CO3测得盐酸为c2mol·L-1在下述情况下,c1﹑c2的关系是:(下面三空填“>”、“<”或“=”)
①当Na2CO3中含有NaHCO3时,则c1 c2;②当Na2CO3中含有NaOH时,则cl c2;
③当Na2CO3中含有Na2CO3·1OH2O,则c1 c2。
20.(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol 据此回答以下两题:
2NH3(g) △H= -92.4KJ/mol 据此回答以下两题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
 ①20Mpa~50 Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
①20Mpa~50 Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
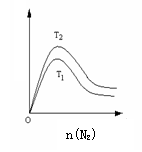
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示
(T-温度)。则T2 T1(填>、=、<),判断的依据是:
;
(3)相同温度下,有恒容密闭容器A、恒压密闭容器B,两容
器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定
条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:
a_____b(填>、=、<),Q1_____ Q2(填>、=、<),Q1_____92.4(填>、=、<)。
19.(4分)已知25℃、101kpa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
△H/(KJ/mol) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
18.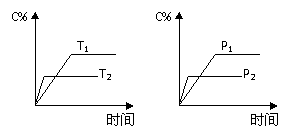 可逆反应aA(g) + bB(g)
可逆反应aA(g) + bB(g) 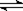 cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
A.达平衡后,加入催化剂则C%增大
B.达平衡后,若升温,平衡左移
C.化学方程式中b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
第Ⅱ卷(非选择题 共46分)
17.体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2 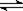 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
A.等于p% B.大于p% C.小于p% D.无法判断
16.有甲、乙两醋酸稀溶液,测得甲的PH=2,乙的PH=3,下列推断中正确的是( )
A.物质的量浓度C(甲)=C(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲.乙两酸的体积V(乙)=10V(甲)
D.甲中的C(OH-)为乙中C(OH-)的10倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com