
题目列表(包括答案和解析)
6.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
( )
A.CO与HbO2反应的平衡常数K=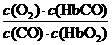
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
5.25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq) +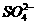 (aq)+
(aq)+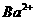 (aq)+2OH
(aq)+2OH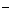 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H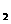 O(1);
O(1); H=
H=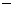 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+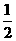 H
H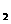 SO4(aq)=
SO4(aq)= 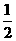 K
K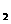 SO4(aq)+H
SO4(aq)+H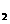 O(I);
O(I); 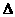 H=
H=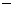 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ 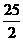 O
O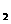 (g)=8CO
(g)=8CO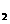 (g)+ 9H
(g)+ 9H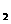 O;
O; 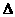 H=
H=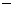 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O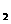 (g)=16CO
(g)=16CO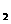 (g)+18H
(g)+18H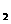 O(1);
O(1); 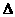 H=
H=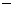 5518 kJ/mol
5518 kJ/mol
4.物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
A.Ba(OH)2、 Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
3.下列说法正确的是 ( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
2.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O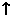 。下列说法正确的是 (
)
。下列说法正确的是 (
)
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
1.下列措施不能达到节能减排目的的是
A.利用太阳能制氢燃料 B.用家用汽车代替公交车
C.利用潮汐能发电 D.用节能灯代替白炽灯
20.(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g) 2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表:
|
状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
|
编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
|
恒容 |
① |
1 |
3 |
0 |
b |
|
② |
0 |
0 |
|
b |
|
|
③ |
|
2.25 |
|
b |
宿迁中学2009-2010学年度第二学期期中考试
19.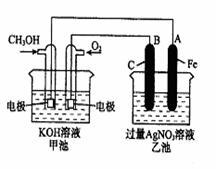 (12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
(12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
|
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,
乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
18.(8分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
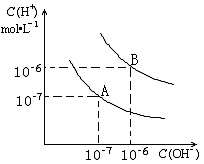 (1)则25 时水的电离平衡曲线应为 (填A或B)
(1)则25 时水的电离平衡曲线应为 (填A或B)
(2)25时,将=9的NaOH溶液与=4的溶
液混合,若所得混合溶液的 =7,则NaOH溶液与
溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前, 与b之间应满足的关系是
17.(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com