
题目列表(包括答案和解析)
28.(13分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS
数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等
而在中和滴定的研究中应用越来越广泛深入。
(1)某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
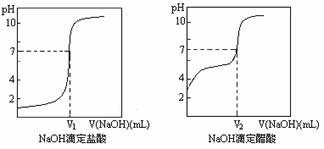 ③由计算机绘制的滴定曲线如下:
③由计算机绘制的滴定曲线如下:
两曲线图中V1_____V2 (填“>”、“=”或“<”),
由滴定曲线可知,实验室用NaOH溶液滴定未知浓度盐酸时,可选择的指示剂为 。
A.酚酞 B.甲基橙 C.石蕊试液 D.甲基红
(2)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
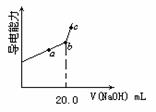 ①用________(填仪器名称)量取25.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果________(填“是”、“否”、“不能确定”)。向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见下图)。
①用________(填仪器名称)量取25.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果________(填“是”、“否”、“不能确定”)。向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见下图)。
②醋酸与NaOH溶液反应的离子方程式为_________。
③图中b点时,溶液中各离子浓度大小的关系
是____________。
④该样品中醋酸溶液的物质的量浓度为_________。
27.(12分)反应2A(g)+B(s)  C(g) +D(g)
C(g) +D(g)
过程中的能量变化如图所示,回答下列问题。
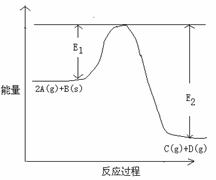 (1)当反应达到平衡时,其它条件不变仅升高温度,
(1)当反应达到平衡时,其它条件不变仅升高温度,
重新达平衡时,平衡常数K ,(填“增大”“减小”
“不变”),理由是 。
(2)当反应达平衡时,保持温度和容器体积不变再充入一定量的A(B足量),重新达平衡时A的体积分数与原平衡相比 (填“变大”“变小”或“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1___,E2__(填“增大”“减小、”“不变”);反应体系中加入催化剂对反应热是否有影响?________,(填“有”或“无”),原因是_________。
(4)恒温、恒容时,下列情况能说明上述反应已达到平衡的是 。
A.容器中气体的压强保持不变 B.B物质的浓度不再改变
C. 2VA(正)=VC(逆) D.容器中气体的密度保持不变
E.C的体积分数不再变化
26.(11分)(1)北京奥运会“祥云”火炬燃料是丙烷,亚特兰大奥运会火炬燃料是丙烯。丙烷脱氢可得丙烯。
已知:C3H8(g) = CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) = CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则①相同条件下,丙烷脱氢制丙烯的热化学方程式 。
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。该电池的总反应方程式为:C3H8+5O2=3CO2+4H2O,正极反应方程式为:O2+2CO2+4e-=2CO32-;则其负极反应方程式为 ,放电时,CO32-移向电池的 (填“正”或“负”)极。
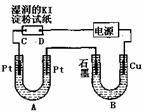 (2)电解装置如下图所示。图中B装置盛1 L 2 mol/LCuSO4溶液,A装置中盛1 L 2 mol/LAgNO3溶液。通电后,润湿的淀粉KI试纸的C端变蓝色。电解一段时间后,试回答:
(2)电解装置如下图所示。图中B装置盛1 L 2 mol/LCuSO4溶液,A装置中盛1 L 2 mol/LAgNO3溶液。通电后,润湿的淀粉KI试纸的C端变蓝色。电解一段时间后,试回答:
①A中发生反应的化学方程式为
②在B中观察到的现象是
③室温下,若从电解开始到时间为t时,A装置中共收集到0.56L(标准状况)气体。若电解过程中无其他副反应发生,电解前AgNO3溶液的pH为5,电解后溶液体积变化忽略不计,则在t时,A溶液的pH约为 。
25.(10分)请按要求填空
(1)请用有关离子反应方程式解释下列事实:
明矾可以净水 ;
小苏打溶液pH约为8 。
(2)在6份0.01mol/L氨水中分别加入或通入少量下列各物质:A.氨气 B.纯水 C.Na2CO3固体 D.冰醋酸 E.NaOH固体 F.Fe2(SO4)3固体。请用A.B.C…填空。
①使C(H+)、C(NH4+)均增大的是 ;
②能使pH增大,使C(NH4+)减小的是 ;
③能使NH3.H2O的电离度增大,C(OH-)减小的是 。
24.在密闭容器中,对于反应N2+3H2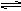 2NH3(气),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为
A. 20mol;75% B.20mol;50% C. 15mol;25% D.40mol;80%
2NH3(气),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为
A. 20mol;75% B.20mol;50% C. 15mol;25% D.40mol;80%
23.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3
溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其
中正确的是
A.NaHSO3溶液:c(H2SO3)<c(SO32-) NaHCO3溶液:c(H2CO3)>c(CO32-)
B.两溶液中均有:c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.NaHSO3溶液:c(Na+)= c(HSO3-)+c(SO32-) ;
NaHCO3溶液:c(Na+)= c(HCO3-)+c(H2CO3)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
22. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭
容器中发生反应。反应过程中H2、N2和NH3物质的量变化
如右图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为 0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时一定是升高了反应温度
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动,达到新平衡后平衡常数K一定比原平衡常数K大
21.现有常温下的四份溶液:
①0.01mol·L-1CH3COOH; ②0.01mol·L-1HC1; ③pH=12的氨水; ④pH=12的NaOH溶液。下列说法正确的是 A.①中水的电离程度最小,③中水的电离程度最大
 B.将②和③等体积混合后pH<7
B.将②和③等体积混合后pH<7
C.将①②溶液稀释相同倍数后,溶液的pH:②>①
D.将①、④等体积混合则混合液一定呈碱性
20.关于甲酸的下列叙述中,不能证明它是弱电解质的是
A. pH值为2的甲酸溶液中加入少量甲酸钠晶体后pH变大
B. 甲酸钠溶液的pH>7
C. 10 mL 1mol / L甲酸恰好能与10 mL 1 mol / L NaOH溶液中和
D. 在相同条件下,甲酸溶液的导电性比盐酸弱
19.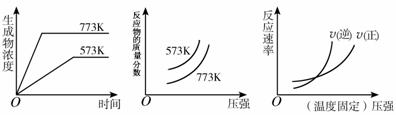 现有下列三个图像:
现有下列三个图像:
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) 2NH3(g);?△H<0
2NH3(g);?△H<0
B.2SO3(g) 2SO2(g)+O2(g);?△H>0
2SO2(g)+O2(g);?△H>0
C.4NH3(g)+5O2(g) 4NO+6H2O(g);△H<0
4NO+6H2O(g);△H<0
D.H2(g)+CO(g) C(s)+H2O(g);△H>0
C(s)+H2O(g);△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com