
题目列表(包括答案和解析)
27.(15分) 生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
 (1)上述反应的催化剂含有Cu、Zn、Al等元素。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
① 写出基态Cu原子的核外电子排布式 。
② 金属铜采用下列 (填字母代号)堆积方式。
A.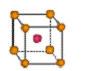 B.
B.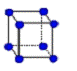 C.
C.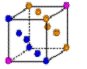 D.
D.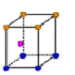
 (2)根据等电子原理,写出CO分子的结构式
。
(2)根据等电子原理,写出CO分子的结构式
。
 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
 ① 甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
① 甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
。
 ② 甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为
。
② 甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为
。
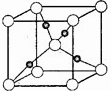
 ③ 在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
③ 在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为
。
(4)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
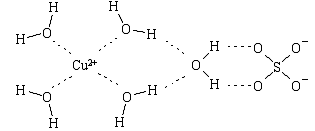
①写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来): 。
②水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 、 。
26.(13分)A、B、C、D四种短周期元素,它们的原子序数依次增大,A和B在同一周期,A原子的p亚层有一个空轨道,B原子的p亚层有两个未成对电子,0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况下),形成的C离子与B离子的电子层结构相同。D离子为阳离子,且D离子的半径在B、C、D离子中为最小。则
(1)写出C原子的电子排布式: ;其在周期表中的位置是第 周期、 族。
(2)A单质和B单质充分反应生成的化合物的路易斯结构式是 。
(3)我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1 mol这种单质中含中子的物质的量是20 mol,则这种同位素原子的符号为 。
(4)比较C和D的最高价氧化物对应水化物酸性或碱性的强弱: 。
(5)在四种元素中,有一个元素的最高价氧化物对应水化物既能与盐酸反应,又能与氢氧化钠反应。写出这两个反应的离子方程式: , 。
25.(13分)有A、B、C、D四种主族元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1。
请回答下列问题:
(1)A元素形成的晶体属于 晶体,其熔点比同周期的金属元素单质的要低,这是因为 。
(2)B- 的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ;C的氢化物的沸点比其相邻周期元素的沸点 (填“高”或“低”),原因是:
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)用电子式表示化合物R的形成过程: 。
24.(8分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
 (1)钛有
(1)钛有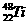 和
和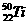 两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第 族;在元素周期表分区中属于 区元素;基态原子的价电子的轨道表示式为
;
两种原子,它们互称为
。Ti元素在元素周期表中的位置是第 周期,第 族;在元素周期表分区中属于 区元素;基态原子的价电子的轨道表示式为
;
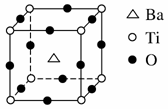
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是 。
23.(7分)有下列8种晶体,用序号回答下列问题:
A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)属于原子晶体的化合物是 ;
(2)含极性键的分子晶体是 ,含有共价键的离子晶体是 ,属于分子晶体但不含化学键的单质是 。
(3)在一定条件下能导电而不发生化学反应的是 ,分子内存在化学键,但受热熔化时,化学键不发生变化的是 ,受热熔化,需克服共价键的是 。
22. 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法不正确的是( )
A. 元素A、B组成的化合物常温下不一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化合物AE与CE具有相同类型的化学键
21.下列排序不正确的是( )
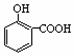
A. 晶体熔点的高低: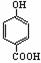 >
>
B. 原子的价层电子数目的多少:Fe > As > K
C. 分子中的键角大小:CO2>H2O>NH3
D. 微粒半径的大小:O2->F->Na+>Li+
20.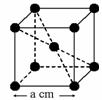 已知某晶体的密度为ρ g·cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g·cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
A.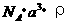 B.
B.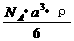
C.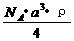 D.
D.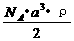
19.现有四种元素。其中两种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;另两种元素的价电子构型为③2s22p3;④2s22p5。则下列有关比较中正确的是( )
A.第一电离能:④>③>①>② B.原子半径:②>①>③>④
C.电负性:③>④>①>② D.最高正化合价:④>①>③=②
18. 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
A.1∶1 B.1∶2 C.1∶3 D.2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com