
题目列表(包括答案和解析)
1、2011年3月11日日本地震损坏核电站设备,引起核泄漏。钚是核工业重要原料,原子核内质子数为94,有多种同位素如钚-238、钚-242、钚-244等,下列关于钚-238说法错误的是
A. 钚是f 区元素 B . .核外电子数238
C. 核内中子数 144 D . 钚是锕系元素
24、(12分)T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、
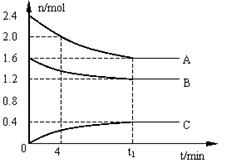 C浓度变化如图所示。(1)写出该反应的方程式:
C浓度变化如图所示。(1)写出该反应的方程式:
(2)计算该温度下该反应的平衡常数:
(3)已知:K(300℃)>K(350℃),该反应是 热反应。
(4)0-4分钟时,A的平均反应速率为:
(5)到达平衡时B的转化率为:
(6)恒容条件下,下列措施中能使n(A)/n(C)降低的有 。
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度
2010学年第二学期十校联合体高二期中联考
23、(12分)某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A、用蒸馏水洗干净滴定管
B、用待测定的溶液润洗酸式滴定管
C、用酸式滴定管取稀盐酸 20.00mL,注入锥形瓶中,加入酚酞。
D、另取锥形瓶,再重复操作一次
E、检查滴定管是否漏水
F、取下碱式滴定管用标准的KOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,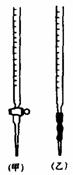 再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)操作F中应该选择右图中哪根滴定管(填标号)
(3)滴定终点溶液颜色的变化是
(4)滴定结果如下表所示:
|
滴定次数 |
待测溶液体积/ml |
标准溶液的体积/ml |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
20 |
1.02 |
21.03 |
|
2 |
20 |
2.00 |
25.00 |
|
3 |
20 |
0.60 |
20.6 |
滴定中误差较大的是第_______次实验,造成这种误差的可能原因是____________________________。
A.碱式滴定管在装液前未用标准KOH溶液润洗2-3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)则该盐酸的浓度为 mol/lL
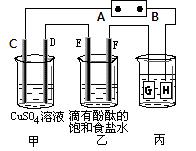
22、(共12分)某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对
应单质的物质的量之比为 ;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是 ,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
21、(4分)请按要求完成下列问题:
(1)已知葡萄糖的燃烧热是2804 kJ/mol,请写出葡萄糖燃烧的热化学方程式:
, 当它氧化生成1g H2O(l)时放出的热量是: ;
(2)向1 mol·L-1纯碱溶液中滴入酚酞溶液,观察到的现象是 ,
 原因是(用离子方程式表示)
。
原因是(用离子方程式表示)
。
20、在一个固定体积的密闭容器中,通入3 L X 气体和2 L Y 气体,在一定条件下发生下列反应:
4X(g)+3Y(g) 2Q(g)+nR(g)。反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值为( )
2Q(g)+nR(g)。反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值为( )
A.3 B.5 C.6 D.7
第Ⅱ 卷(共40分)
19、已知298K时反应2SO2(g)+ O2(g) 2SO3(g) △H=-197 kJ·mol-1,在相同温度下向一密
2SO3(g) △H=-197 kJ·mol-1,在相同温度下向一密
闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1mol SO2和0.5 molO2,达化学平衡时放出热量为a2kJ ,则下列关系式中正确的是 ( )
A.2a2>a1 >197 B.2a2<a1<197 C.2a2 = a1 >197 D.2a2 = a1 = 197
18、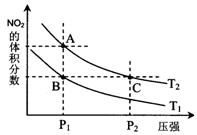 反应N2O4(g)
反应N2O4(g) 2NO2(g) △H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、B两点气体的颜色:A深,B浅
C.T1>T2
D.A、C两点气体的平均相对分子质量:A>C
17、用两根铂丝作电极插入KOH溶液中,再分别向两极通入氢气和氧气,可形成燃料电池,该电池放电时的总反应为:2H2+ O2= 2H2O,下列说法错误的是( )
A.通氢气的一极为负极,通氧气的一极为正极
B.氢氧燃料电池在使用时不会产生对环境有害的物质,属于一种环保的电池
C.放电过程中,KOH的浓度不会发生变化
D.通氢气的电极反应式是:H2+2OH――2e- = 2H2O
16、室温下,将PH分别为12和2、体积相等的氨水和盐酸两种溶液混合后所得溶液的酸碱性判断正确的是( )
A.混合后溶液呈酸性 B.混合后溶液呈碱性
C.混合后溶液呈中性 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com