
题目列表(包括答案和解析)
18、(12分)工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案。
图中所使用的仪器和药品已由下面的装置图中给出。
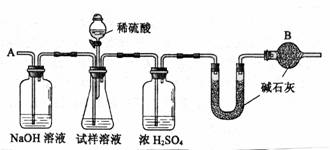
主要实验步骤如下:
①检查装置的气密性
②称取a g(准确到0.1g,下同)试样放入锥形瓶中,加适量蒸馏水溶解
③称量盛有碱石灰的U型管的质量为b g
④从分解漏斗滴加6mol.L-1的硫酸溶液,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量为c g
⑦重复步骤⑤⑥的操作,至称量所得的质量基本不变为d g
试回答下列问题:
(1)步骤②和③两次称取(量)的操作上显著的不同之处是________________________
_______________________________________________________________________________。
(2)实验中使用NaOH溶液和碱石灰的一个共同的作用是_________________________。
(3)如果将实验中的硫酸溶液换成相同浓度的盐酸,测定的结果将_____________(填写“偏高”、“偏低”或“不变”)。其原因是___________________________________________。
(4)步骤⑤(⑦)操作时要求“缓缓鼓入”的目的是____________________________。
(5)利用上述实验中获得的数据,该工业纯碱的纯度为__________________________。
(6)完成本实验的方案不止一种,沉淀法便是其中的一种。化学探究小组的同学经讨论后认为若以该法实验,可供选择的试剂可能有:
A、Ba(NO3)2(BaCl2)溶液 B、Ca(NO3)2(CaCl2)溶液 C、AgNO3、稀HNO3溶液
你认为理论上可行的是_______(填序号),最佳的是_____________,请说明你不作出选择的理由________________________________________________________________________
_______________________________________________________________________________。
17、(10分)(1)下列有关实验(原理、操作)的叙述中,正确的是_____(请填写序号)。
A、用pH试纸较为准确地测试氯水的酸碱度
B、硫酸铜晶体中结晶水含量的测定实验中至少进入四次称量操作
C、用铝屑、NaOH溶液、稀硫酸、蒸馏水制备Al(OH)3,第一步应以稀NaOH溶液对铝屑进行预处理
D、中和热测定实验中可用金属丝(棒)代替环形玻璃搅拌棒
E、用升华法分离镁粉和碘粉的混合物
F、检验红砖中的氧化铁成份时,向红砖粉末中加入盐酸,静置,取上层清液于试管中,滴加2-3滴KSCN溶液即可
(2)用已准确称量的1.06gNa2CO3固体配制0.100mol.L-1的Na2CO3溶液100mL,所需要的仪器有______________________________________________。除去KCl溶液中的SO42-离子,依次加入的试剂为(填溶质的化学式)__________________________________________。
16、某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4•5H2O)的质量(温度维持不变)的实验数据
|
硫 酸 铜 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
加入的无水硫酸铜(g) |
2.5 |
4.0 |
6.0 |
8.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
2.8 |
6.4 |
10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A、3.42g B、3.88g C、6.82g D、2.56g
第Ⅱ卷(非选择题 共86分)
15、下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
|
选项 |
陈 述 Ⅰ |
陈 述 Ⅱ |
判 断 |
|
A |
工业生产硫酸用水吸收SO3 |
SO3可与水反应 |
Ⅰ对;Ⅱ对;有 |
|
B |
工业上用废铁屑与硫酸制备FeSO4时通常向反应溶液中加入洁净的废铁屑 |
铁可以还原Fe3+成Fe2+ |
Ⅰ对;Ⅱ对;有 |
|
C |
江河的入海处易形成“三角洲” |
胶体是一种相对稳定的 分散系 |
Ⅰ对;Ⅱ错;无 |
|
D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且 导电性好 |
Ⅰ对;Ⅱ对;有 |
14、设NA代表阿伏加德罗常数,下列说法正确的是
A、12.4g白磷(P4,正四面体型)中含有P-P共价键个数为0.4NA
B、100mLpH=2的盐酸与醋酸溶液中氢离子数均约为1×10-3NA
C、标准状况下,22.4L氩气与22.4L氟气所含质子数均为10NA
D、1L0.1mol/LNa2CO3溶液中CO32-和HCO3-总数为0.1NA
13、下列各种溶液中,一定不能大量共存的离子组是
A、pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B、由水电离的c(H+)=10-14mol·L-1的溶液中: K+、Na+、Ca2+、HCO3-
C、含有大量Fe3+的溶液中:Mg2+、Al3+、Cu2+、SO42-
D、使紫色石蕊试液变蓝色的溶液中:Na+、AlO2-、S2-、SO42-
12、下列离子方程式书写正确的是
A、硫酸亚铁溶液与过氧化氢溶液混合:Fe2++H2O2+2H+=Fe3++4H2O
B、将少量硝酸银溶液滴入氨水中:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O
C、KAl(SO)2溶液中滴加Ba(OH)2溶液使SO42-恰好完全沉淀
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
直流电
D、电解饱和食盐水:2Cl-+2H2O==H2↑+Cl2↑+2OH-
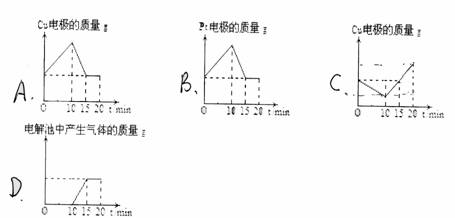
11、将质量相等的铜片和铂片插入足量的硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图正确的是
10、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是
A、正极反应为:O2+2H2O+4e-=4OH-
B、电池工作时,电流由铝电极沿导线流向铂电极
C、以网状的铂为正极,可增大与氧气的接触面积
D、该电池通常只需要更换铝板就可继续使用
9、在下列实验中,不能达到目的的是
A、用饱和NaHSO3溶液除去SO2气体中混有的HCl
B、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D、测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com