
题目列表(包括答案和解析)
19.(12分)(1)化学反应方程式表示: __________ ;
原因是 ;
实验操作步骤应为 、
(2)四组方案中, __________ 组方案最好。
(3)装置B的作用是 __________ 。
(4)装置C的作用是 __________ 。
(5) ③ __________ 。
(6)
18、(10分)① (填代号)。
②_______ (填代号)。
③ 、
(写化学式)。
④ mol 。
⑤(选填代号) 。
16.(10分) ⑴写出S2Cl2的电子式 。
⑵试剂为 ,其作用为 ;
原因是 ;名称是 ,
它的作用是 。
⑶该实验的操作顺序应为 (用序号表示)。
⑷放置的试剂为 ,其作用为 。
17(12分)(1)写出其中可能发生的两个氧化还原反应的化学方程式:
、
。
(2)① ;② ;
③ 。
(3) 。(填字母)
15.(12分) (1) (填字母标号)。
(2)(Ⅰ) ; (Ⅱ) ;
(Ⅲ) (填分离操作的名称)。
② (Ⅰ) 管通入 ,再从 管通入 气体;
(Ⅱ) ;
(3): .
21.(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知: ①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:

②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
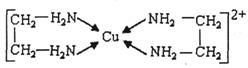
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是__________________________。
 (4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
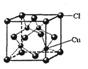
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
高三化学答卷纸
20.(10分)铜是一种重要的金属元素,铜元素与银元素同处第ⅠB族,+1价的铜和+1价的银都可形成二配位的络离子,如Ag(NH3)2+、AgCl2-等,含铜最丰富的天然资源是黄铜矿(CuFeS2)。
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 、 。
|
|
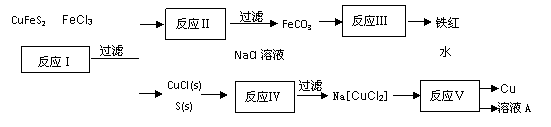
①写出反应Ⅰ中FeCl3与CuFeS2所发生反应的化学方程式: ;
②写出反应Ⅳ中发生反应的离子方程式: 。
③反应Ⅲ是FeCO3在空气中煅烧,写出化学方程式: 。
④反应Ⅴ所得溶液A中含有的溶质有 。
19.(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
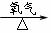 乙组: Cu
CuO
CuSO4
乙组: Cu
CuO
CuSO4
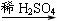
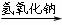
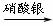 丙组: Cu
Cu(NO3)2
Cu(OH)2
CuSO4
丙组: Cu
Cu(NO3)2
Cu(OH)2
CuSO4
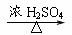 丁组: Cu
CuSO4
丁组: Cu
CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4 CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;②实验结束时干燥管D总质
 量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
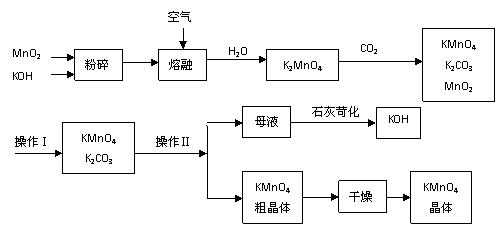
18、(10分)17.(11分)工业上制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是___(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
③上述流程中可以循环使用的物质有 、 (写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
17.(12分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答 下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
16.(10分)S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。
在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
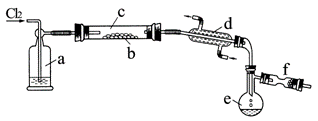
⑴已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
⑵装置a中应放试剂为 ,其作用为 ;装置c水平放置的原因是 ;装置d的名称是 ,它的作用是 。
⑶该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
⑷图中f装置中应放置的试剂为 ,其作用为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com