
题目列表(包括答案和解析)
0.3mol 0.6mol 0.2mol
Fe2+、NO3-过量,故产生NO气体:0.2mol÷4×22.4 L/mol=1.12L
26. ⑴ 16.8
⑴ 16.8
⑵NO3-
(3)解:3Fe2+ + NO3- + 4H+ = 3Fe3++NO↑+2H2O
24.
.(1)①产生白色沉淀,迅速变灰绿色,最终变红棕色;(1分)
②FeCl2+2NaOH==Fe(OH)2↓(1分);4Fe(OH)2+O2+2H2O==4Fe(OH)3(1分)
(2)①2Fe3++3Cl2+8H2O==2FeO42- +6Cl-+16H+ (2分)
②SCN-被Cl2氧化(1分);从电子式分析,SCN-中S为负二价,N为负三价均为最低价有被氧化的可能(1分)
25①现象为溶液紫红色褪去接近无色(2分)
离子方程式为6H++2MnO4-+5HOOC-COOH === 2Mn2++10CO2↑+8H2O(3分)
乙二酸具有还原性(1分),价态可能是+2价(1分)
②原因是
二水合乙二酸晶体在达到分解温度之前已经熔化并流至试管口端,不会分解(2分);
试剂是
澄清石灰水、氢氧化钠溶液、澄清石灰水(3分),作用是证明二氧碳已经除尽(1分)
23.(共13分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (3分)
CuSO4+SO2↑+2H2O (3分)
(2)碱液(其他合理答案均可给分);(2分)
(3)贮存多余的SO2气体(2分) d(1分)
(4)①小于0.09 mol (3分)
②a、d (2分)
22.(15分)
(1)2Na2O2+2H2O=4NaOH+O2↑ (2分) 0.2NA (2分)
(2)Cl2+2OH-= Cl- + ClO- +H2O (3分)
(3) C、浓H2SO4 (2分)
(4)2NH4Cl+Ca(OH)2 CaCl2 +2H2O+2NH3↑
(3分)
CaCl2 +2H2O+2NH3↑
(3分)
(5)2Fe(OH)3 + 3 ClO-+4OH-=2FeO42-+3 Cl-+5H2O (3分)
21.(15分,每空3分)
(1)氧氰
(2)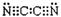
(3)(SCN)2+2KOH=KSCN+KSCNO+H2O
(4)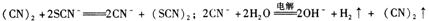
20.(5分)(1)分液 (2)过滤 (3)蒸发 (4)渗析 (5)蒸馏(或分馏)
(各1分,错别字不给分)
1.C2.D 3C 4.D 5D6 C 7.B 8 B 9C 10A11C12B 13C 14A15 D16 C 17C18C 19B 20D
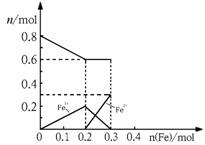
27.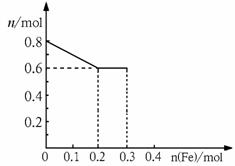 (7分)取m g铁粉与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。
(7分)取m g铁粉与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。
(1)若反应后的溶液中滴加KSCN溶液不变红色,则m= ▲ ;
(2)若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的某离子的物质的量的变化曲线如图所示,则该曲线表示的是_ ▲ _物质的量变化,请你在此图中再画出另外2种离子的物质的量的变化曲线并注明离子种类 ▲ 。
(3)在(2)反应后的溶液中加入含0.1molH2SO4的稀硫酸,计算还能产生的气体的体积 ▲ (标况下)。
答案()
26.(8分)菠菜中有含铁元素的物质和乙二酸。乙二酸俗称草酸,易溶于水。其主要物理常数如下:
|
名称 |
分子式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
密度 (g/cm3) |
|
乙二酸 |
H2C2O4 |
无色固体 |
8.6(20℃) |
189.5 |
1.900 |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
-- |
101.5 |
1.650 |
某化学小组同学为了研究草酸(乙二酸的结构HOOC-COOH)的化学性质,进行以下实验:
(1)该小组同学向盛有5mL硫酸酸化的0.5%(质量分数的)KMnO4溶液的试管中滴加足量的乙二酸饱和溶液,振荡,观察到现象为 ▲ ,写出该反应的离子方程式 ▲ ;
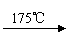 由此可推知乙二酸具有 ▲ (填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是 ▲ ;
由此可推知乙二酸具有 ▲ (填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是 ▲ ;
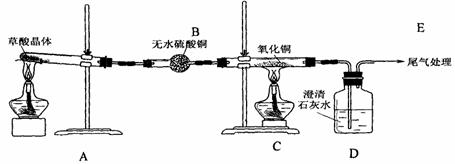 (2)已知草酸分解的化学方程式为H2C2O4
H2O+CO2↑+CO↑。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。
(2)已知草酸分解的化学方程式为H2C2O4
H2O+CO2↑+CO↑。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。
①实验前,有同学提出用二水合乙二酸晶体进行实验,遭到大家的反对,其原因是 ▲
;
②有同学提出这个实验不能检验二氧化碳气体,还需在B、C之间加入4个洗气瓶,依次加入的试剂是 ▲ 、 ▲ 、 ▲ 和浓硫酸,其中第3个洗气瓶的作用是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com