
3.(2012·重庆高考)下列叙述正确的是( )
A.Fe与S混合加热生成FeS2
B.NaHCO3的热稳定性大于Na2CO3
C.过量的铜与浓硝酸反应有一氧化氮生成
D.白磷在空气中加热到一定温度能转化为红磷
[解析] S是一种氧化性较弱的非金属单质,与变价金属反应时生成金属的低价态化合物,硫元素化合价为-2价;酸式盐的热稳定性要小于正盐;过量的铜与浓硝酸反应,随反应的进行,浓硝酸逐渐变为稀硝酸,与铜反应时生成NO;白磷转化为红磷需要隔绝空气加热到一定温度,白磷在空气中加热会转化为五氧化二磷。
[答案] C
2.(2012·山东高考)下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
[解析] SO2使品红褪色不是因为氧化性,而是因为SO2有漂白性,SO2与H2O生成的H2SO3与有色物质结合成无色物质;B项不能排除SO的干扰,原溶液中含有SO、SO中的一种或两种均可出现题述现象;Fe与稀HNO3发生氧化还原反应生成NO气体,不是置换反应;D项正确。
[答案] D
1.(2013·上海高考)将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
|
选项 |
X |
Y |
|
A |
SO2 |
H2S |
|
B |
Cl2 |
CO2 |
|
C |
NH3 |
CO2 |
|
D |
SO2 |
Cl2 |
[解析] A项将SO2通入BaCl2溶液,不反应,部分SO2溶解在水中后与后来通入的H2S 发生反应2H2S+SO2===3S↓+2H2O生成S沉淀,B项始终不反应无现象,C项反应为2NH3+H2O+CO2+BaCl2===2NH4Cl+BaCO3↓,D项发生反应:SO2+Cl2+2H2O===H2SO4+2HCl BaCl2+H2SO4===BaSO4↓+2HCl,因此选B。
[答案] B
3.注意反应形式与物质的关系,特别是置换反应
(1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H2O(或H+)―→H2,2Mg+CO22MgO+C。
(3)非金属―→非金属:2F2+2H2O===4HF+O2,2C+SiO2Si+2CO↑,C+H2O(g)CO+H2,X2+H2S===2HX+S↓(F2除外)。
(4)非金属―→金属:用H2、C冶炼金属。
通过反应形式梳理化学反应,培养归纳、整理能力。
 (2013·广东高考)下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
(2013·广东高考)下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
|
选项 |
叙述Ⅰ |
叙述Ⅱ |
|
A |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
|
B |
Fe3+具有氧化性 |
用KSCN溶液可以鉴别Fe3+ |
|
C |
溶解度:CaCO3<Ca(HCO3)2 |
溶解度:Na2CO3<NaHCO3 |
|
D |
SiO2可与HF反应 |
氢氟酸不能保存在玻璃瓶中 |
[解析] A项,叙述Ⅱ对应的原因是NH4Cl受热易分解;B项,叙述Ⅱ对应的原因是Fe3+与SCN-生成配合物,显血红色;C项,叙述Ⅱ中溶解度:Na2CO3>NaHCO3;D项,氢氟酸不能保存在玻璃瓶中是因为玻璃中含有SiO2,SiO2能与HF反应。
[答案] D

2.以氧化还原反应理论为指导,抓元素化合价的变化
氧化还原反应是复习元素化合物知识的重要线索,依据氧化还原反应原理可以判断物质性质及反应产物,通过化合价可以推知物质的性质。
一、元素及其化合物综合题的备考方略
元素化合物知识是高考基本概念和基本理论命题的载体,高考考查元素化合物的知识主要以通性为主,其次考查一些重要物质的特殊性。所考查的性质主要有热稳定性、酸碱性、氧化性、还原性,其中氧化性、还原性是考查的重点。对化学方程式的考查大多源于教材,并适当延伸,即材料在教材之外,原理在教材之内。
为了提高备考效率,复习时要注意以下三点:
1.抓知识主线,辨重点、难点,建知识网络
复习元素及其化合物知识时,要注意各物质之间的联系,通过物质之间的联系形成知识网络。
6.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是________(选“A”或“D”)。
(2)元素C在元素周期表中位置是________,B的最高价氧化物的水化物的电子式为________。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2∶2∶1,该盐的名称为________。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为:_____________________。
[解析] A是地壳中含量最高的元素,A是氧;D的氢化物和最高价氧化物的水化物均为强酸,D是氯;B、C、D三元素在第3周期,它们的最高价氧化物的水化物两两混合均能发生反应生成盐和水,根据B、C、D原子序数依次增大,因此B是钠,C是铝;E为原子序数大于17的前20号元素,且与其他元素既不同周期也不在同主族,推知E为Ca。
[答案] (1)D (2)第3周期ⅢA族 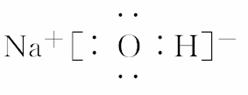
(3)次氯酸钙 ClO-+2H++Cl-===Cl2↑+H2O
5.A、B、C、D四种短周期元素,原子序数依次增大。A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B的原子数之比为4∶1,由A、C组成的两种化合物乙、丙都是液态,乙中A、C原子数之比为1∶1,丙中A、C原子数之比为2∶1,由D、C组成的两种化合物丁和戊都是固体,丁中D、C原子数之比为1∶1,戊中D、C原子数之比为2∶1,写出下列物质的化学式:甲________,乙________,丙________,丁________,戊________。
[解析] 根据原子个数比为4∶1的气态化合物,直觉将甲猜为CH4,再根据乙、丙分别是由A、C元素形成的原子数之比为1∶1、2∶1的液态化合物,直觉将乙猜为H2O2,丙猜为H2O;根据A、D同主族,顺推A、B、C、D四种元素分别为氢、碳、氧、钠,最后根据B、C同周期,D、C形成原子个数比为1∶1、2∶1的固体化合物,分别为Na2O2、Na2O符合实际,则猜想正确。
[答案] CH4 H2O2 H2O Na2O2 Na2O
4.有三种相邻元素A、B、C,已知A、B处于同一周期,且B、C处于同一主族相邻位置。又知这三种元素原子的质子数之和是31,最外层电子数之和为17,试推断A、B、C各为何种元素。
[解析] 方法一:=7…2,=13(整除),故一种元素为7N。又由于17既不能被3整除,也不能被2整除,则另外两元素都在偶数族,只能是8O和16S,经验证符合题意。
方法二:此题也可用图示法解法如下
分析题意,我们可将A、B、C这三种元素在元素周期表中的位置,列出如下四种情形:
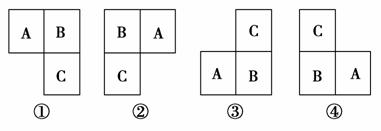
再根据三种元素的原子序数的关系,列出代数式,求解,简单直观。
设B的质子数为x。根据三种元素原子的质子数之和为31,综合分析上述四种情况,可列出以下四个代数方程式:
①(x-1)+x+(x+8)=31,解之得x=8;
②x+(x+1)+(x+8)=31,解之得x=(不合理);
③(x-1)+x+(x-8)=31,解之得x=(不合理);
④(x+1)+x+(x-8)=31,解之得x=(不合理)。
则A:质子数8-1=7,是氮元素;B:质子数为8,是氧元素;C:质子数为8+8=16,是硫元素。N、O、S三种元素原子的最外层电子数之和为5+6+6=17,符合题意。
[答案] A为N元素,B为O元素,C为S元素。
3.X和Y是短周期元素,二者能形成化合物X2Y3,若Y的原子序数为n,则X的原子序数不可能是( )
A.n-8 B.n-3
C.n-1 D.n+5
[解析] 由化学式X2Y3可知,X为+3价,Y为-2价,即X可能为第ⅢA族或第ⅤA族元素。有如下几种可能
ⅢA ⅥA ⅤA ⅥA
X Y X Y
5B 8O 7N 8O
13Al 16S 15P 16S
据以上分析,可知答案为A。
另解:由化学式X2Y3知,X、Y的原子序数,一个为奇数一个为偶数,根据“序、价”规律可判断A项正确。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com