
2.仪器选取是否正确
该方面往往从仪器的选择、组装等设置问题。如量取液体是用量筒还是用滴定管、仪器能否加热、加热时是否需垫石棉网等。
一、视图题
视图题信息量大,直观性强,能够考查考生的多种能力。解此类题,通常需从以下几方面分析:
1.原理是否正确
该方面主要从试剂选择(搭配)是否合理、反应条件是否充分等设置问题。如制取氯气时是否用浓盐酸、是MnO2还是KMnO4、是否有加热装置等。
6.(1)三种弱酸HA、H2B、HC电离常数的数值为:1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)===A-+H2B
②H2B(少量)+C-===HB-+HC
③HA(少量)+C-===A-+HC
则三种酸对应的电离常数分别为(请填空):
|
HA |
H2B |
HC |
|
|
Ka |
Ka1 |
Ka2 |
Ka |
|
1.8×10-5 |
4.3×10-7 |
|
|
(2)25 ℃时,0.1 mol·L-1的H2D水溶液中,用氢氧化钠来调节溶液的pH,得到含有H2D、HD-、D2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=________(填微粒间量的关系)。
②当c(Na+)=c(D2-)+c(H2D)+c(HD-)时溶液为________溶液(填物质的化学式)。
[解析] (1)由反应式①知,酸性HA>H2B;由反应式②知,酸性H2B>HC>HB-;由反应式③知,酸性HA>HC。则有Ka(HA)>Ka(H2B)>Ka(HC)>Ka(HB-)。
(2)①根据溶液中电荷守恒,得c(Na+)+c(H+)=c(HD-)+2c(D2-)+c(OH-),当pH=7时,即c(H+)=c(OH-),则c(Na+)=c(HD-)+2c(D2-)。
②根据物料守恒,只有当溶质为NaHD时,才能使溶液中c(Na+)=c(D2-)+c(HD-)+c(H2D)。
[答案] (1)
|
HA |
H2B |
HC |
|
|
Ka |
Ka1 |
Ka2 |
Ka |
|
1.8×10-5 |
4.3×10-7 |
5.6×10-11 |
4.9×10-10 |
(2)①c(HD-)+2c(D2-) ②NaHD
5.化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
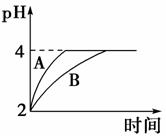
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是______,(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO水解程度大于HCO所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)_____________________________________。
[解析] (1)醋酸溶液中存在CH3COOH CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=,c(OH-)=10-9 mol·L-1;c(OH-)=(mol2·L-2),c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO生成,本题就转化为检验溶液中是否有CO。
CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=,c(OH-)=10-9 mol·L-1;c(OH-)=(mol2·L-2),c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO生成,本题就转化为检验溶液中是否有CO。
[答案] (1)B < (2)5 6
(3)向溶液中加入足量BaCl2(或CaCl2)溶液,如果无白色沉淀生成说明甲正确,有白色沉淀产生说明乙正确
4.若25 ℃时某一元酸HA的电离平衡常数Ka=1×10-8,将0.1 mol·L-1的HA溶液和0.1 mol·L-1的NaA溶液等体积混合后,则混合溶液( )
A.呈中性 B.呈碱性
C.呈酸性 D.不能确定溶液的酸碱性
[解析] 溶液中存在:HA H++A-
H++A-
Ka=1×10-8
A-+H2O OH-+HA
OH-+HA
Kh=c(HA)×c(OH-)/c(A-)=c(HA)×Kw/c(H+)×c(A-)=Kw/Ka=1×10-14/1×10-8=1×10-6。
因Kh>Ka,即水解大于电离,故c(OH-)>c(H+),溶液显碱性。
[答案] B
3.已知:25 ℃时醋酸的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,水的离子积常数:Kw=c(H+)·c(OH-)=1×10-14。则25 ℃时,0.1 mol·L-1 CH3COONa水溶液中,c(OH-)约为(已知:=1.34)( )
A.1×10-7 mol/L B.1.8×10-6 mol/L
C.7.5×10-6 mol/L D.7.5×10-5 mol/L
[解析] 本题设计的意图是利用数学关系巧妙代换求出水解平衡常数,灵活地考查了水解平衡常数与电离平衡常数、水的离子积常数之间的关系。分析如下:
CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
起始: 0.1 0 0
改变: x x x
平衡: (0.1-x) x x
Kh=c(CH3COOH)c(OH-)/c(CH3COO-)
=Kw/Ka
即:x2/(0.1-x)=1×10-14/(1.8×10-5)
因CH3COONa的水解程度很小,则(0.1-x)≈0.1,上式可变为:
x2/0.1=1×10-14/(1.8×10-5)
x=1×10-5/()=7.5×10-6。
[答案] C
2.化学平衡常数K、弱电解质的电离平衡常数Ka或Kb及溶度积常数Ksp是高中化学中常见的几种常数。它们都能反映相应的可逆变化进行的程度,下列关于以上常数的说法正确的是( )
A.对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大
B.一定温度下,在a mol·L-1的饱和石灰水中加入适量的b mol·L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出
C.相同温度时,CH3COOH的电离平衡常数Ka与NH3·H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性
D.升高温度,以上常数均增大
[解析] 只有改变温度,化学平衡常数才改变,A选项错误;B选项,依据Ksp[Ca(OH)2]=c(Ca2+)·c2(OH-),加入CaCl2后溶液中的c(Ca2+)增大,但溶液体积也增大,c(OH-)降低,最终c(Ca2+)·c2(OH-)的值可能小于Ksp[Ca(OH)2],错误;C选项,由电离平衡常数相等,可知CH3COONH4显中性,但醋酸的酸性大于碳酸的酸性,所以NH4HCO3的水溶液显碱性,正确。
[答案] C
1.有一兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验。恒温条件下,向一个容积为10 L的密闭容器中充入1
mol A和1 mol B,反应达平衡时测得容器中各物质的浓度如Ⅰ中所示,然后改变条件做了另外三组实验,重新达到平衡时容器中各成分的浓度分别如Ⅱ、Ⅲ、Ⅳ中所示。
C(g)+D(s)的影响,进行了如下实验。恒温条件下,向一个容积为10 L的密闭容器中充入1
mol A和1 mol B,反应达平衡时测得容器中各物质的浓度如Ⅰ中所示,然后改变条件做了另外三组实验,重新达到平衡时容器中各成分的浓度分别如Ⅱ、Ⅲ、Ⅳ中所示。
|
|
A |
B |
C |
|
Ⅰ |
0.050
mol·L-1 |
0.050
mol·L-1 |
0.050
mol·L-1 |
|
Ⅱ |
0.070
mol·L-1 |
0.070
mol·L-1 |
0.098
mol·L-1 |
|
Ⅲ |
0.060
mol·L-1 |
0.060
mol·L-1 |
0.040
mol·L-1 |
|
Ⅳ |
0.080
mol·L-1 |
0.080
mol·L-1 |
0.12
mol·L-1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的化学平衡常数K=20
B.Ⅱ中的数据可能是通过增大C的浓度来实现的
C.若Ⅲ中只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.由Ⅳ中的数据得出,通过压缩容器的体积就可以实现
[解析] 选项A结论正确,由Ⅰ中数据可计算出该反应的化学平衡常数。选项B结论正确,增大C物质的浓度,平衡左移,A、B的浓度也会增大,但是达到新的平衡时C的浓度一定比开始时的大。选项C结论正确,分析Ⅲ和Ⅰ中的数据可知:升高温度,平衡左移,说明逆反应是吸热反应,则正反应为放热反应。选项D结论错误,将Ⅳ中A、B、C的浓度代入平衡常数表达式,计算出K≠20,单纯地通过压缩容器的体积无法实现。
[答案] D
4.利用平衡常数判断化学反应的正误
 (2013·上海高考)部分弱酸的电离平衡常数如下表:
(2013·上海高考)部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HCN |
H2CO3 |
|
电离平衡常数(25 ℃) |
K1=1.77×10-4 |
K1=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2===2HCN+CO
B.2HCOOH+CO===2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
[解析] 根据电离平衡常数可知:酸性HCOOH>H2CO3>HCN>HCO,因此,A错误,B正确;等体积、等pH的HCOOH和HCN所含溶质HCN多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
[答案] AD

3.利用平衡常数确定溶液的pH或酸碱性
 (2013·新课标全国卷Ⅱ)室温时,M(OH)2(s)
(2013·新课标全国卷Ⅱ)室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
A.lg() B.lg()
C.14+lg() D.14+lg()
[解析] Ksp[M(OH)2]=c(M2+)·c2(OH-)=a,c(M2+)=b mol·L-1,则有c(OH-)=() mol·L-1,结合水的离子积常数可知,c(H+)===10-14· mol·L-1,那么pH=14+lg()。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com