
2.CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1
1.CO(g)+2H2(g)===CH3OH(g) ΔH=-90.1 kJ·mol-1
8.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) 2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
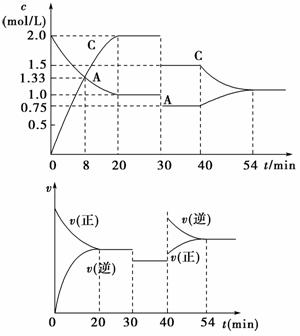
(1)30 min时改变的条件是________,反应方程式中的x=________。
(2)反应过程中B的转化率最大的时间段是________min。
(3)该反应的ΔH________0(填“>”、“=”或“<”)。
(4)有甲、乙两个完全相同的容器,向甲容器中加入1 mol A(g)和2x mol B(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol C(g)和x mol B(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中B的转化率为________。
[解析] (1)A、C的浓度同时减小相同倍数,应是扩大体积,减小压强。
(2)40 min后逆向移动,B的转化率减小,故最大的时间段为20~40 min。
(3)40 min是升温,平衡逆向移动,ΔH<0。
(4)若1 mol A和2x mol B完全反应则热量变化为5Q,故甲中B的转化率为×100%×50%=10%。
[答案] (1)减压 1 (2)20~40 (3)< (4)10%
7.在恒温恒容的密闭容器中,发生反应:3A(g)+B(g) xC(g)。Ⅰ.将3
mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a;Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是( )
xC(g)。Ⅰ.将3
mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a;Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是( )
A.若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应满足3n(B)>n(A)+3
D.若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4
[解析] 这是恒温恒容条件下的等效平衡,无论如何进行配比,只要把反应一端按反应计量数之比完全转化为另一端的物质后,相当于完全等同的起始量即可。A项,A、B、C各增加1 mol时,A与B不可能完全转化为C,加入的B相对量大,A的转化率增大,而B的转化率将减小,错误;B项,在Ⅰ平衡体系中再加入3 mol A和2 mol B,相当于增大了体系的压强,C的体积分数增大,说明平衡向正反应方向移动,正反应方向体积缩小,x<4,错误;C项,假设C完全转化为A、B,则n(A)+3/2n(C)=3,n(B)+1/2n(C)=2,即3n(B)=n(A)+3,错误;D项,设C完全转化为A、B,则xn(A)+3n(C)=3x,xn(B)+n(C)=2x,即2xn(A)+3n(C)=3xn(B),正确。
[答案] D
6.(2013·江苏高考)一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1
mol CO和1 mol H2O,在Ⅱ中充入1
mol CO2和1 mol H2,在Ⅲ中充入2
mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1
mol CO和1 mol H2O,在Ⅱ中充入1
mol CO2和1 mol H2,在Ⅲ中充入2
mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
[解析] 容器Ⅰ中反应正向进行,放出热量,容器Ⅱ中反应逆向进行,吸收热量,两个容器中反应温度不同,则Ⅰ、Ⅱ中正反应速率不相同,A错。容器Ⅲ中加入反应物的量比容器Ⅰ中多,由于该反应为放热反应,Ⅲ中放出热量比Ⅰ多,Ⅲ中反应正向进行的程度比Ⅰ小,因此容器Ⅲ中反应的化学平衡常数比Ⅰ小,B错。 Ⅰ中反应正向进行,放出热量,Ⅱ中反应逆向进行,吸收热量,由于容器均为绝热容器,Ⅰ和Ⅱ中反应进行的程度均较小,则C、D均正确。
[答案] CD
5.
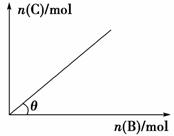
在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g) 5C(g)+D(g) ΔH<0,在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
5C(g)+D(g) ΔH<0,在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
A.图中曲线的斜率表示反应的化学平衡常数
B.若保持压强一定,当温度降低时,θ变大
C.增加A的物质的量可缩短达平衡所需的时间
D.若保持容器体积不变,再通入B,则反应混合物的温度降低
[解析] 平衡常数只与温度有关,A错。由于A是固体,增加A的量不影响化学反应速率,C错。选项D中通入B,平衡正向移动,反应放出更多的热,导致体系温度升高。
[答案] B
4.
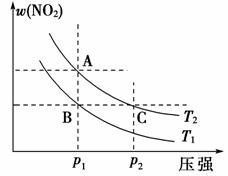
反应N2O4(g) 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是( )
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是( )
A.由图可知B点时平衡常数与C点时相同
B.A、C两点气体的颜色:A深,C浅
C.A、C两点气体的平均相对分子质量:A<C
D.保持容器体积不变,再充入N2O4气体,平衡逆向移动
[解析] 由于B点和C点对应的温度不同,因此平衡常数也不同,选项A错。由于p(C)>p(A),平衡逆向移动,w(NO2)减小,w(N2O4)增大,但c(NO2),C点比A点大,所以C点混合气体的颜色深,A点浅,B错。选项D中再充入N2O4气体,相当于增大反应物浓度,化学平衡应向正反应方向移动,D错。
[答案] C
3.(2014·甘肃高三第一次高考诊断)对于可逆反应:2A(g)+B(g) 2C(g) ΔH<0,下列图象正确的是( )
2C(g) ΔH<0,下列图象正确的是( )
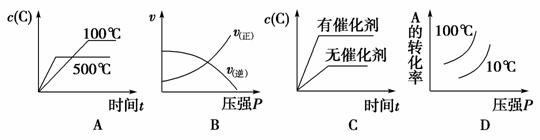
[解析] A项,温度升高平衡左移,C的浓度减小,故A正确;B项,压强增大,正反应速率和逆反应速率都增大,而图像中逆反应速率减小,故B错误;C项,催化剂只能改变反应速率,不能使化学平衡发生移动,C错误;D项,温度升高平衡左移,A的转化率降低,而图像中A的转化率升高,故D错误。
[答案] A
2.可逆反应A(g)+2B(g) 3C(g)+4D(g) ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图象正确的是( )
3C(g)+4D(g) ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图象正确的是( )
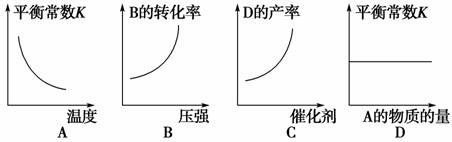
[解析] A项,该反应是吸热反应,升温平衡正向移动,则平衡常数K应增大,A错;B项,增大压强平衡逆向移动,则B的转化率降低,B错;C项,催化剂不能使化学平衡发生移动,则D的产率不变,C错;D项,化学平衡常数只受温度影响,故正确。
[答案] D
1.
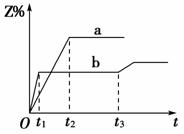
(2014·北京通州摸底)两体积相同的密闭容器中均充入1
mol X和1 mol Y,分别于300 ℃和500 ℃开始发生反应:X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是( )
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是( )
A.曲线a是500 ℃时的图象
B.正反应是吸热反应
C.t3时刻可能是增大了压强
D.t3时刻可能是降低了温度
[解析] A项,温度较高,达到平衡所用时间短,所以b曲线应是500 ℃时的图象;B项,由a→b即升高温度Z%下降,说明平衡向逆反应方向移动,则正反应应是放热反应;C项,t3时刻不会是增大压强,因增大压强平衡逆向移动,Z%下降。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com