
3.除杂和检验方法
|
物质 |
检验试剂 |
除杂试剂(或方法) |
|
甲烷(乙烯) |
高锰酸钾酸性溶液或溴水 |
溴水 |
|
酒精(水) |
无水硫酸铜 |
生石灰 |
|
淀粉(葡萄糖) |
新制的氢氧化铜悬浊液 |
|
|
苯(乙醇) |
Na |
水,萃取、分液 |
|
乙酸乙酯(乙酸) |
紫色石蕊试液或NaHCO3溶液 |
饱和Na2CO3溶液 |
|
乙烷(二氧化硫) |
品红溶液 |
高锰酸钾酸性溶液、溴水或NaOH溶液 |
|
乙烯(二氧化硫) |
品红溶液 |
NaOH溶液 |
 下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
①金属钠 ②溴水 ③碳酸钠溶液 ④紫色石蕊试液
A.①②③④均可 B.只有①②④
C.只有②③④ D.只有③④
[解析] 在溶液中加入鉴别试剂的现象:
|
|
乙酸 |
乙醇 |
苯 |
氢氧化钡 |
|
碳酸钠溶液 |
有气体生成 |
混溶 |
分层 |
有白色沉淀 |
|
紫色石蕊试液 |
溶液呈红色 |
混溶 |
分层 |
溶液呈蓝色 |
[答案] D

2.常用的试剂及与其反应的有机物
能与溴水(或溴的四氯化碳溶液)反应的有机物(乙烯等含碳碳不饱和键的有机物);与高锰酸钾酸性溶液反应的有机物(乙烯等含不饱和键的有机物、乙醇、葡萄糖);与新制的氢氧化铜悬浊液反应的有机物(醛类、葡萄糖);与氢氧化钠溶液反应的有机物(乙酸);与碳酸钠溶液反应的有机物(乙酸);与钠反应的有机物(含有羟基的有机物如乙醇、乙酸等)。
1.有机物的溶解性规律
(1)烃类的密度都小于水,都难溶于水(它们浮在水面上),但可溶于有机溶剂。
(2)烃的衍生物中:①四氯化碳(CCl4)、溴苯(C6H5Br)的密度大于水,且难溶于水,但可溶于有机溶剂;②乙醇、乙酸、葡萄糖、蔗糖易溶于水和有机溶剂;③油脂、酯类不溶于水,密度比水小。
5.Ⅰ.某硝酸厂附近的空气主要污染物为氮的氧化物。为了保护环境和综合利用,可采用氨-碱两级吸收法。此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
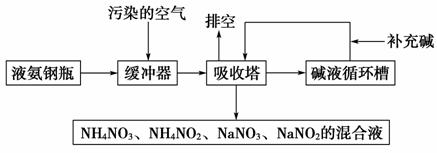
(1)排空物质的主要成分为__________________。
(2)进入吸收塔以前加一个缓冲器的目的是__________________。
(3)从吸收塔排出的混合液用途之一为_____________________。
Ⅱ.空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
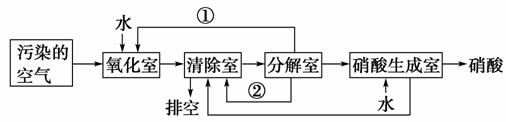
各室中发生的反应如下:
氧化室:NO2(g)+SO2(g)+H2O(l)===H2SO4(l)+NO(g)
ΔH=a kg·mol-1。
清除室:NO(g)+NO2(g)===N2O3(g)
ΔH=b kJ·mol-1;
N2O3(g)+2H2SO4(l)===2NOHSO4(s)+H2O(l)
ΔH=c kJ·mol-1。
分解室:4NOHSO4(s)+O2(g)+2H2O(l)===4H2SO4(l)+4NO2(g)
ΔH=d kJ·mol-1。
回答下列问题:
(1)①和②分别为(写化学式)________、________。
(2)写出SO2、O2和H2O反应生成H2SO4的热化学方程式:__________________。
[解析] Ⅰ.(1)排空物质是无污染的气体,主要成分为N2、O2。(2)进入吸收塔以前加一个缓冲器的目的是使氨气和污染的空气充分混合,使氮的氧化物与氨气充分反应,从而转化为无毒的N2。(3)从吸收塔排出的混合液含有铵盐,可以作为氮肥。
Ⅱ.(1)根据各室中的反应,物质①、②分别为分解室中NOHSO4与O2、H2O反应生成的NO2、H2SO4。
(2)设3个室中发生的4个反应依次为①、②、③、④,根据盖斯定律,反应2SO2(g)+O2(g)+2H2O(l)===2H2SO4(l)可以通过①×2+②×2+③×2+④得到,则该反应的ΔH=(2a+2b+2c+d)kJ·mol-1。
[答案] Ⅰ.(1)N2、O2(只填N2也算对)
(2)使氨气和污染的空气充分混合
(3)作肥料(其他合理答案也可)
Ⅱ.(1)NO2 H2SO4
(2)2SO2(g)+O2(g)+2H2O(l)===2H2SO4(l)
ΔH=(2a+2b+2c+d)kJ·mol-1
三、无机非金属材料的应用及环境保护
无机化工原理在考查方面的另外一个着力点是以全新的信息考查化学反应原理在合成氨、工业制H2SO4、氯碱工业及无机非金属材料方面的应用。近几年来一些省市高考题中的传统无机框图题由于人为设计成分较多、问题编制模式过于单一、逻辑推理味浓厚而化学味道淡薄,故已被工业生产流程题取而代之;该题型是对传统无机框图题的变革和创新,取材于真实的广阔的工业生产和日常生活,问题设计更加灵活,更有化学味,是落实高考对考生素质和能力要求的具体体现。取材于真实的化学工业中有关废气的处理,编制于高考化工流程题中,体现了化学“真实性”的一面,同时起到增强绿色环保理念的作用。
中学化学需要掌握的重要的化工生产原理如下:


 (2014·聊城模拟)工业合成氨与制备硝酸一般可连续生产流程如下:
(2014·聊城模拟)工业合成氨与制备硝酸一般可连续生产流程如下:
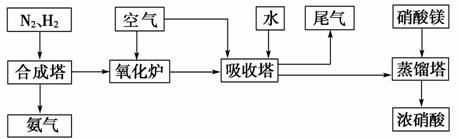
(1)简述原料气N2、H2的来源:____________________________。
(2)下列可以代替硝酸镁加入到蒸馏塔中的是________。
A.浓硫酸 B.氯化钙
C.氯化镁 D.生石灰
(3)氨气和氧气145 ℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
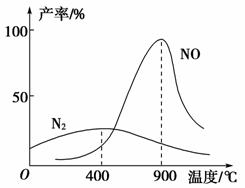
4NH3+5O2 4NO+6H2O K1=1×1053(900 ℃)
4NO+6H2O K1=1×1053(900 ℃)
4NH3+3O2 2N2+6H2O K2=1×1067(400 ℃)
2N2+6H2O K2=1×1067(400 ℃)
温度较低时以生成________为主,温度高于900 ℃时,NO产率下降的原因:____________________。
吸收塔中需要补充空气的原因:______________________。
(4)尾气处理时,小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2,请写出有关反应的化学方程式:______________________。
[解析] 硝酸镁是吸水剂,四个选项中各物质都具有吸水性,但只有浓硫酸对产物没有影响,生石灰可与硝酸反应,氯化钙、氯化镁中的Cl-会与H+结合生成HCl,在加热时易挥发而混在硝酸中。
[答案] (1)N2来源于空气,H2来源于焦炭与水蒸气的反应
(2)A
(3)N2 生成NO的反应为放热反应,升高温度,平衡向逆反应方向移动,NO的产率下降 提高氨气的转化率,进一步与NO反应,尽可能多的生成所需产品
(4)NO+NO2+H2O===2HNO2
CO(NH2)2+2HNO2===CO2↑+2N2↑+3H2O

4.“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
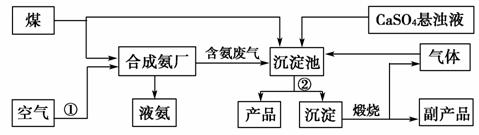
请回答下列问题:
(1)工艺操作①、②分别为________、________。
(2)工业合成氨的化学方程式为_______________。
(3)写出生成“产品”的离子方程式:_______________________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是_________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
[解析] (1)合成氨的原料之一氮气来源于空气,分离方法是将空气液化后蒸馏分离出氧气,获得氮气。
(2)工业合成氨的条件是高温、高压和催化剂。
(3)“产品”是硫酸铵,反应物是硫酸钙悬浊液、二氧化碳、氨气等,产物除产品硫酸铵外,还有碳酸钙沉淀。
(4)氨气溶于水显碱性,实验室中可以用湿润的红色石蕊试纸检验,或利用氨气与氯化氢化合为氯化铵的反应进行检验等。
(5)分析框图中各物质的关系可知“副产品”为氧化钙,能够循环使用的物质是二氧化碳。
[答案] (1)将空气液化后蒸馏分离出氧气,获得氮气 过滤
(2)N2+3H2 2NH3
2NH3
(3)CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH+SO
(4)用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法)
(5)CaO CO2
3.在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2===C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OH B.CO2和H2O
C.H2和CO2 D.CH3OH和H2
[解析] 从原子守恒和绿色化学的思想出发:CH3C≡CH+其他的反应物―→CH2===C(CH3)COOCH3,则其他的反应物的原子组成为C2H4O2,只有选项A中的物质按等物质的量混合符合题意。
[答案] A
2.(2014·汕头模拟)工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( )
A.C3H83C+4H2
B.C3H8C3H6+H2
C.C3H8+6H2O3CO2+10H2
D.2H2O2H2+O2
[答案] C
2.原子经济性
原子经济性在化学合成特别是有机合成中,减少废物的关键是提高选择性问题,即选择最佳反应途径,使反应物原子尽可能多地转化成产物原子,最大限度地减少副产物,才会真正减少废物的生成。美国著名有机化学家B.M.Trost在1991年首先提出“原子经济性”的概念:认为高效的有机合成应最大限度地利用原料分子的每一个原子,使之结合到目标分子中(如完全的加成反应:A+B===C),达到零排放。原子经济性可用原子利用率来衡量,其定义可表示为原子利用率=×100%。
经济性的反应有两个显著优点:一是最大限度地利用了原料,二是最大限度地减少了废物的排放。
 在下列制备环氧乙烷的反应中,原子利用率最高的是( )
在下列制备环氧乙烷的反应中,原子利用率最高的是( )
A.CH2===CH2+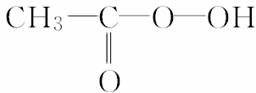 (过氧乙酸)―→
(过氧乙酸)―→
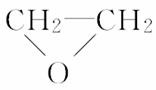 +CH3COOH
+CH3COOH
B.CH2===CH2+Cl2+Ca(OH)2―→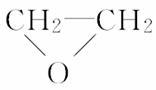 +CaCl2+H2O
+CaCl2+H2O
C.2CH2===CH2+O2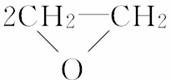
D. HOCH2CH2—O—CH2CH2OH+
HOCH2CH2—O—CH2CH2OH+ +2H2O
+2H2O
[解析] 根据原子利用率内涵,副产物越少原子利用率越高。C项的副产物为0,则原子利用率为100%,答案为C。也可以分别计算其他方法的原子利用率,再比较。A项原子利用率:×100%≈42.3%;B项原子利用率:×100%≈25.4%;C项原子利用率:×100%=100%;D项原子利用率:×100%≈23.7%。所以原子利用率大小:C>A>B>D。
[答案] C

二、绿色化学
1.绿色化学有关概念
(1)核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
绿色化学的理想在于不再使用有毒有害的物质,不再产生废物,不再处理废物,这是一门从源头上减少或消除污染的化学。
(2)绿色化学的研究主要围绕化学反应、原料、催化剂、溶剂和产品的绿色化开展的,因此化学反应及其产物具有以下特征:
a.采用无毒、无害的原料;
b.在无毒、无害的条件(包括催化剂、溶剂)下进行;
c.产品应该是环境友好的;
d.具有“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“零排放”。此外,它还应当满足“物美价廉”的传统标准。
1.汽车的发明与使用,是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,同时由此引发的环境污染问题也越来越引起人们的关注。
(1)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是________。
A.燃烧含氮化合物燃料引起的
B.燃烧含铅汽油引起的
C.是由于燃烧不充分引起的
D.是在汽缸中N2被氧化生成的
(2)下列有关城市各项污染源与其造成的恶果排列正确的是________。
A.汽车尾气—光化学烟雾 工业废气—酸雨 工业废水—“公害病”
B.汽车尾气—酸雨 工业废气—“公害病” 工业废水—光化学烟雾
C.汽车尾气—“公害病” 工业废气—酸雨 工业废水—光化学烟雾
D.汽车尾气—光化学烟雾 工业废气—“公害病” 工业废水—酸雨
(3)一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) ΔH<0。现利用此反应,拟设计一种环保装置以消除汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是________。
N2(g)+2CO2(g) ΔH<0。现利用此反应,拟设计一种环保装置以消除汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是________。
①选用适当的催化剂 ②提高装置的温度 ③降低装置的压强 ④在装置中装入碱石灰
A.①③ B.②④
C.①④ D.②③
(4)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,解决了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于上述有害气体的是________。
A.CO2和H2 B.NO2和NO
C.CO和SO2 D.碳粒和含铅化合物
(5)为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是________。
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
[解析] (1)汽车在工作时发动机的活塞在汽缸中运行一个循环时要经过进气、压缩、点火燃烧和排气四个过程,所以又叫四冲程内燃机。在压缩和点火燃烧等过程中由于高压高温,故空气中N2和O2发生如下反应:
N2+O2高温高压2NO,2NO+O2===2NO2生成污染大气的NO2、NO。
(2)可结合各种尾气、废气、废水的主要成分及危害分析。
(3)由于以上“可逆”反应仅能“缓慢”发生,故可“催化”加速;由于正反应为放热过程,故不宜温度太高;由于正反应为气体总体积减小的反应,故不宜减压;将装置中加入能与产物CO2反应的物质有利于平衡右移。
(4)CO2和H2均不属于有害气体。
(5)天然气(主要成分CH4)、液化石油气(C3~C5的烃)其成分均为碳氢化合物,完全燃烧的产物为CO2和H2O,不造成环境污染,但生成的CO2却是造成温室效应的元凶。
[答案] (1)D (2)A (3)C (4)A (5)B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com