
3.糖类是人体所需能量的主要来源。日常饮食中,糖类主要来自下列食物中的 ( )
A.米饭 B.蔬菜 C.牛奶 D.豆制品
2.从2008年6月1日起,在全国范围内实行“限塑令”。下列图标中属于我国的塑料回收标志的是( )

A B C D
1.探究物质的变化是学习化学的重要内容。下列变化中属于化学变化的是 ( )
A.酒精挥发 B.瓷碗破碎 C.食物腐败 D.石蜡熔化
29.(7分)国家规定,酿造食醋总酸含量不得低于3.5g/100 mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食用白醋的总酸含量,进行了如下实验:
首先取10 mL该白醋样品,稀释至 100 mL;然后,取稀释后的溶液20 mL用溶质质量分数为0.4%的NaOH溶液中和,当消耗NaOH溶液15g时,恰好完全反应(醋酸与氢氧化钠反应的化学方程式为:CH3COOH+NaOH=CH3COONa+H2O,假设其他物质不与氢氧化钠反
应)。
计算:(1)20mL稀释后的溶液中醋酸的质量;
(2)该市售白醋样品中的总酸含量,并说明是否符合国家标准。
28.(13分)某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
[查阅资料](1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水。
[猜想](1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液。
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别。
[实验探究](1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
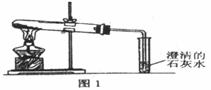
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的。
[问题讨论](1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3)。请写出Na2CO3与澄清石灰水发生反应的化学方程式 ;写出NaHCO3与澄清石灰水混合时参与反应的离子: 。
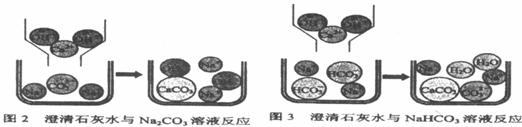
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的化学方程式为 ;而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:
CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到
现象来鉴别Na2CO3和NaHCO3溶液的。
至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是 ;根据你分析:Na2CO3受热 分解(填“易”或“不易”)。在加热NaHCO3固体时,丙同学观察到的实验现象是
(任写一种)。
[拓展应用](1)固体Na2CO3中混有少量NaHCO3,可通过 方法除去。
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的 溶液。
27.(7分)以下是我们熟悉的实验室制取气体的发生装置、收集装置以及净化装置(装置⑦中碱石灰为固体氢氧化钠和氧化钙的混合物)。请根据装置图回答下列问题:
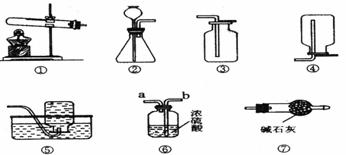
(1)将装置①中的固体加热时应先 ;若用装置⑥净化气体,则气体应从 端通入(填“a”或“b”)。
(2)实验室用过氧化氢溶液和二氧化锰制氧气,应选用的发生装置为 、收集装置为
(填装置的编号),过氧化氢溶液应从 中加入(填仪器名称),其中二氧化锰起 作用。
(3)实验室常用加热氯化铵与氢氧化钙固体混合物的方法制取氨气。通常情况下,氨气的密度比空气小且极易溶于水。若要制得干燥的氨气,则装置的连接顺序为 (填装置的编号)
26.(8分)下图转化关系中(其中部分产物已略去),A是一种难溶于水的碳酸盐;E是一种蓝色沉淀,受热分解后,得到金属氧化物和水;K是一种白色沉淀。请回答下列问题:
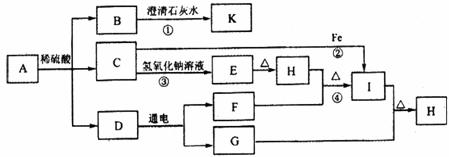
(1)A物质中所含金属阳离子的符号为 ,物质G的化学式为 ;
(2)指出下列反应所属的基本反应类型:③为 反应,④为 反应;
(3)写出下列反应的化学方程式:反应① ,反应② 。
25.(6分)化学知识在生产、生活中有广泛的应用。
(1)“5·12”汶川大地震发生后,为了保证饮用水的安全卫生,灾区使用了某种净水消毒泡腾片,其有效成分是二氧化氯。二氧化氯的化学式为 ,其中氯元素的化合价为 。
(2)“水立方”是2008年北京奥运会的主游泳馆,它的墙体与屋面上紧密却不规则地排列着浅蓝色气泡。制作该气泡的材料是乙烯-四氟乙烯的聚合物(ETFE)膜材,它属于 材料(填“金属”或“有机合成”)。为确保“水立方”泳池的水质达到国际泳联最新卫生标准,将采用砂滤-臭氧-活性炭净水工艺净化泳池里的水,其中砂滤的作用是 ,臭氧的主要作用可能是 ,使用活性炭是利用它的 性。

24.(4分)下图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线。在t1℃时,将质量为a g的A、B、C三种物质分别加入100 g水中,根据图示回答下列问题:
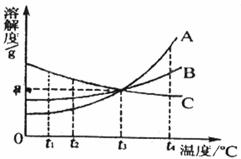
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t1℃时,所得三种物质的溶液中为不饱溶液的是 ;
(3)若使这三种溶液溶质的质量分数相等,则温度应由t1℃升至 ℃;
(4)若将温度由t1℃升至 t4℃时,三种溶液中溶质质量分数的大小关系为 。
23.(5分)车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料。
(1)乙醇分子中,组成元素的原子个数比C:H:O为 。
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W。现测得反应前后各物质的质量如下:
|
物质 |
乙醇 |
氧气 |
二氧化碳 |
水蒸气 |
W |
|
反应前质量/g |
23 |
40 |
0 |
0 |
0 |
|
反应后质量/g |
0 |
0 |
22 |
27 |
x |
①根据质量守恒定律,得出表中x的值为 ;
②根据表中数据,可确定未知物W中各组成元素的质量比为 ;
(3)通常可燃物中碳元素质量分数越高,燃烧产生 W越多。则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是 ;为了使乙醇汽油燃烧过程中少产生 W,应采取的措施是 (任写一种)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com