
22.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态无机化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x_(用●表示)位于该正方体的顶点和面心。
该化合物的化学式是____ _____。

、21(8分) 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式_____________ _。
②取代反应前后各元素的化合价一般不变。试写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式________________ _。
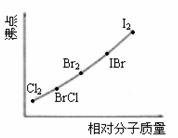
⑵右上图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是_______ _______。
⑶试推测ICl的沸点所处的最小范围______ ________。
20.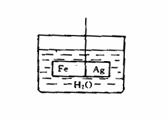 (10分)(1)在装有水的烧杯里,用细线挂一个呈水平方向的由Fe和Ag焊接成的圆柱棒,如右图。
(10分)(1)在装有水的烧杯里,用细线挂一个呈水平方向的由Fe和Ag焊接成的圆柱棒,如右图。
①向烧杯中加入CuSO4溶液后,忽略溶液密度的变化,看到的现象是 。
②发生上述变化的电极反应式是 。
(2)已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3。写出下列反应的离子方程式:①向小苏打溶液中滴加少量溴水: ;
②向苏打溶液中滴加少量溴水: 。
19.(10分)(1)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程中,能直接表示出氯化钠晶体的晶格能的是 。
A.Na+(g)+Cl-(g) NaCl(s);△H
B.Na(s)+1/2Cl2(g) NaCl(s); △H1
C.Na(s) Na(g);
△H2 D.Na(g)-e- Na+(g); △H3
E.1/2Cl2(g)
Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
②写出△H与△H1、△H2、△H3、△H4、△H5之间的关系式
。
(2)如右图为氯化钠晶体的结构模型,氧化亚铁晶体结构与氯化钠晶体结构相似,则:
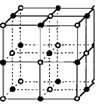 ①氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子个数是
。
①氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子个数是
。
②设阿伏加德罗常数值为NA,若氧化亚铁的密度为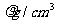 ,
,
则氧化亚铁晶体中二价铁离子与氧离子之间最近距离
是 cm(用代数式表示)
③若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧
离子的数目将______ (填“减少”、“增多”或“保持不变”)。
18.(8分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄的物质是 。
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.稀硝酸
C.四氯化碳 D.硫氰化钾溶液
甲和乙推断正确的是 ,用合适的方法加以验证,写出选用的试剂(限上述提供的试剂)及实验中观察到的现象。 。
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? ,
理由是:
17.(10分)(1) 下列有关实验操作或判断不正确的是________(填有关序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
 D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)实验室利用如右图装置进行中和热的测定。
回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将
(填“偏大”、“偏小”或“不变”);原因是 。
16.用惰性电极和串联电路电解下列物质浓溶液①HCl ②NaNO3 ③CuCl2 ④AgNO3,在相同时间内生成气体总体积(相同状况)在理论上由多到少的顺序是
A.④③②① B.①②③④ C.①③②④ D.③④①②
第二卷
15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn - 2e- + 2OH- == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- == FeO42- + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
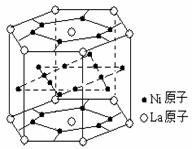
14.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
13.破坏1mol化学键所需要的能量叫键能。下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
 C.金刚石的硬度、熔点、沸点都高于晶体硅
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com