
27.(14分)某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了在量资料,获得了草酸的一些信息,整理出下表:
|
(1)草 酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
|
熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
|
(2)无 水草酸 |
结构简式 |
HOOC-COOH |
溶解性 |
能溶于水或乙醇 |
|
特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
|
化学性质 |
H2C2O4+Ba(OH)2=BaC2O4↓+2H2O |
|||
HOOC-COOH 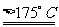 CO2↑+CO↑+H2O↑ CO2↑+CO↑+H2O↑ |
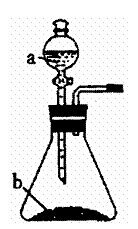
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
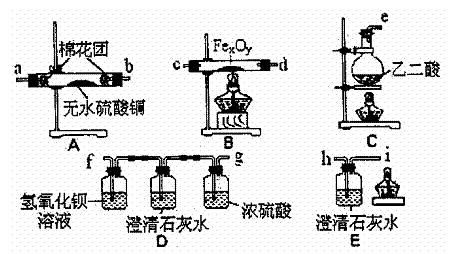
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接h。
(2)该组同学进行了下列实验操作:
|
②检查实验装置的气密性并装入药品;
③反应结束后,行熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再
熄灭c处的酒精灯;
④点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学时行数据处理。反应前,称得硬质玻璃管的质量为54.00g,样品FexOy的质量为7.84g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
26.(14分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
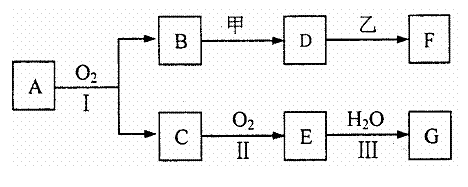
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
|
③反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②写出B和甲反应的化学方程式是 。
③若17gA与O2反应生成气态的B和C时放出226.7kJ热量,写出该反应的热化学方程式: 。
25.(16分)某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:
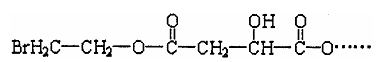
已知X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
(1)C中只有一种位置的氢原子。
(2)室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为
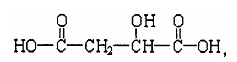
试回答:
(1)B中所含官能团的名称是 。
(2)C的结构简式为 。
(3)E不能发生的反应类型是 (填序号)
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标准状况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)
。
(5)在一定条件下两分子E可以生成六元环酯,定出此反应的化学方程式:
。
13.关于原子核,下列说汉不正确的是 ( )
A.α粒子散射实验说明原子核有复杂结构
B.10个放射性元素的原子核经一个半衰期有5个发生了衰变
C.一个中子和一个质子结合成氘核时,释放出核能,表明此过程中出现了质量亏损
D.原子核中任一核子只与相邻核子间有很强的核力作用
第Ⅱ卷(非选择题,共11小题,共180分)
12.将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。用数轴表示的下列化学知识中,正确的是 ( )
A.常温条件下,酚酞的变色范围: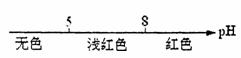
B.分散系的分类: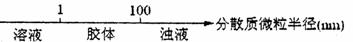
C.AlCl3和NaOH溶液反应后铝元素的存在形式:
|
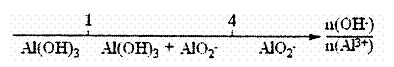
D.CO2与NaOH溶液反应的产物: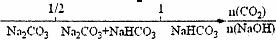
11.工业上由二氧化锰制备KMnO4分两步进行:
①二氧化锰与氢氧化钾共熔并通入O2:2MnO2+4KOH+O2
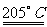 2K2MnO4+2H2O
2K2MnO4+2H2O
②电解锰酸钾溶液:2K2MnO4+2H2O  2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
根据上述内容,判断下列正确的是 ( )
A.氧化性K2MnO4>O2
B.每生成1molKMnO4共转移6mol电子
C.第②步电解时,阴极周围溶液的pH值减小
D.第②步电解时,KMnO4在阳极区生成
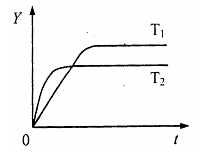
9. 已知反应N2(g)+3H2(g) 2NH3(g);
△H<0,向某体积恒定的密闭容器中按体 积比1:3充入N2和H2,在一定条件下
发生反应。右图是某物理量(Y)随时 间(t)变化的示意图,Y可以是( )
已知反应N2(g)+3H2(g) 2NH3(g);
△H<0,向某体积恒定的密闭容器中按体 积比1:3充入N2和H2,在一定条件下
发生反应。右图是某物理量(Y)随时 间(t)变化的示意图,Y可以是( )
A.N2的转化率 B.混合气体的密度
C.密闭容器的压强 D.H2的体积分数
|
A.可用Ba(OH)2溶液同时鉴别FeCl3、AlCl3、MgCl2、Fe(NO3)2、Na2SO4五种溶液
B.取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,加热后不会产生红色沉淀
C.用电石制取乙炔常因混有PH3、H2S等杂质而有特殊难闻的臭味
D.可用下图装置制取的气体有NO2、NH3、O2、CO2
8.已知0.1mol/L的二元酸H2A溶液的pH=4,则下列说法中不正确的是 ( )
A.在Na2A和NaHA溶液中离子种类相同
B.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-)+2c(H2A)
7.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为 ( )
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
6.设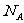 为阿伏加德罗常数,下列说法不正确的是 ( )
为阿伏加德罗常数,下列说法不正确的是 ( )
A.用含0.01molFeCl3的饱和溶液制成的Fe(OH)3胶体中所含胶粒数小于0.01NA
B.标准状况下,22.4LCl2和HCl的混合气体中含分子数为NA
C.30g甲醛中含有的共用电子对数为4NA
D.0.1
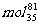 Br原子中含中子数为3.6NA
Br原子中含中子数为3.6NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com