
13.下列说法正确的是( )
A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子
B.某物质经科学测定只含有一种元素,则可经断定该物质是一种纯净物
C.利用化学方法 ,我们可以制造出新分子,但不能制造出新原子
D.由两种元素组成的电解质分子中,显正价的是阳离子,是为负价的是阴离子
12.下列说法正确的是( )
A.根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
B.以Fe、CuO 、CuCl2溶液、盐酸、KOH溶液为反应物,两两可发生的反应有4个
C.碱不一定都有对应的碱性氧化物
D.向胶体中加蔗糖溶液,产生聚沉现象
11.一定能在下列溶液中大量共存的离子组是 ( )
A.水电离产生的c(H+)=1×10-12mol·L-1溶液:NH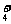 、Na+、Cl-、HCO
、Na+、Cl-、HCO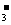
B.能使pH试纸变深蓝色的溶液中:Na+、[Al(OH)4]-、S2-、CO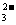
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO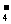 、Al3+、SO
、Al3+、SO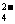
10.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下, 8. 96L丁烷中含有的共价键数为4NA
D.在1L 2mol·L-1的硫酸铁溶液中含有的铁离子数为4NA
9.下列有关实验的描述正确的是( )
A.用湿润的pH试纸测定稀盐酸的pH
B.不能在石英坩埚中熔融氢氧化钠
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.为了除去乙酸乙酯中混有的少量乙酸,可向其中加入适量的乙醇,加热
33.(8分)[化学一有机化学基础)
已知有机物A不能发生银镜反应,也不能使溴水褪色;在一定条件下,A的苯环上发生卤代反应时只能产生两种一卤代物;A在一定条件下还能发生如下图所示的反应。B与过量的银氨溶液能发生银镜反应;C中具有八元环结构;D溶液中加入浓硝酸会有白色沉淀产生,加热,沉淀变黄色;E能使溴水褪色。
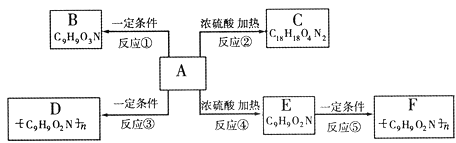
请回答:
(1)写出A的化学式:__ __
(2)写出下列变化的基本反应类型:
A C:__
__ E
C:__
__ E F:
___
F:
___
(3)写出D的结构简式:_ __
(4)B发生银镜反应的离子方程式
(5)若E中的苯环和各官能团均保持不变,苯环上取代基的数目、位置和化学式也不改变。则符合上述条件的E的同分异构体(除E外)还有_____种。
32.(8分)(化学一物质结构与性质)
已知A、B、C是原子序数依次增大的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子排布式为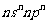 ,C元素的第一电离能在同族元素中最大且高于与其同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子排布式为
,C元素的第一电离能在同族元素中最大且高于与其同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子排布式为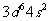 。
。
请回答:
(1)D元素较稳定的化合价是__。
(2)C与A形成的最简单分子是__分子(填:“极性”或“非极性”),该分子再与A+结合形成离子时,ACA键的键角发生改变,其原因是 ___
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
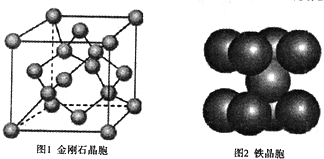
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原于。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是__ _
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是rcm,则铁的密度是 ___。
31.(8分)[化学一化学与技术]
在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们:
(1)合成氨的化学原理是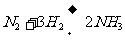 ,在工业上选择20-50MPa的较高压强和 500
,在工业上选择20-50MPa的较高压强和 500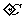 的温度来进行反应,请结合有关的化学原理解释。
的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气;B.由煤或焦碳来制取氢气:煤或焦碳经加热,炽热的炭与水蒸气反应生成氢气;C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳,一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳。
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气一一氮气和氢气。
氮气和氢气的混合气体在合成塔一定条件下,通过催化扭l的作用产生氨气,再通过氮分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。
30.(16分)Ⅰ.大多数的化学反应都是可逆反应。
在一个容积为2.0L的固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 
 3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
(1)用B的浓度变化来表示的反应速率u(B)=____。该反应在此条件下
的化学平衡常数K=____(结果用分数表示)。
(2)在相同实验条件下,若在同一容器中加人2.0molA和8.0molB,若要求平衡后C在反应混合气中体积分数不变,则还应加入C ____mol。
(3)在相同实验条件下,若在同一容器中加人3.0molA和一定量的B,平衡时C的物质的量为3.0mol,则加入的B的物质的量为____mol
Ⅱ.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合,所得溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是( )
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C. c(Na+)=c(HA)+c(A-)
D.c(OH-)=c(H+)+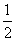 [c(HA)一c(A-)]
[c(HA)一c(A-)]
(2)常温下,在20mL0.1mol/L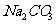 溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(
溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(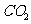 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
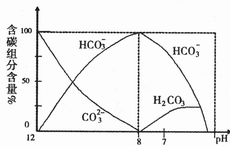
回答下列问题:
①在同一溶液中,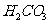 ,、
,、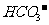 、
、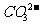 (填:“能”或“不能”)____大量共存。
(填:“能”或“不能”)____大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:____
③已知在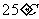 时,
时,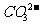 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数
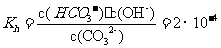 ,当溶液中c(
,当溶液中c(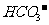 ):c(
):c(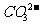 )=2:1时,溶液的pH:___。
)=2:1时,溶液的pH:___。
(选做部分)
共8个题,考生从中选2个物理题、1个化学题和1个生物题作答。
29.(14分)能源是人类社会发展进步的物质基础,能源、信息、材料一起构成了现代文明的三大支柱。甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料,并且能显著降低汽车尾气对大气的污染。
Ⅰ.请写出甲醇的电子式_ __;与甲醇的物质的量相同的某有机物,完全燃烧时消耗的氧气的量也与甲醇相同,写出符合上述条件的任一有机物的化学式__ __。
Ⅱ.已知CH30H(1)+02 (g)=CO(g)+2H2 0(g)
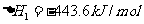
2CO(g)+02 (g)=2C02 (g) 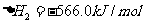
(1)试写出CH30H(1)完全燃烧[生成H2O(g)]的热化学方程式:
(2)有人建议,投资研究由CO2和H2O(g)来制取CH3OH(1),如果成功,既能缓解能源紧张,又能解决温室效应的问题。请你分析论证,该建议是否可行?
Ⅲ.(1)以甲醇溶液、氧气为基本反应物的新型燃料电池已经问世,其结构如图所示(甲醇解离产生的H+可以通过质子交换膜进入另一极)。请写出甲醇在电极上反应的方程式:________, 当有32g甲醇被完全氧化时,转移电子____mo1。
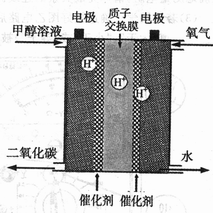
(2)某同学以甲醇燃料电池为电源,均以石墨为电极电解CuSO4溶液,则与电源正极相连的电解池电极上的电极反应式为____
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com