
28.(12分)甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的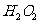 溶液,通过反应
溶液,通过反应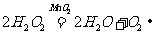 来制取氧气,则在下列A、B、C三装置中最佳装置是_____
来制取氧气,则在下列A、B、C三装置中最佳装置是_____
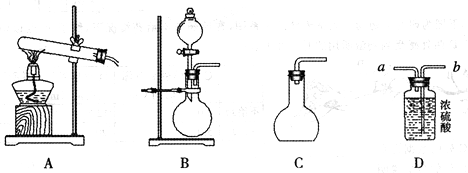
②与气体发生装置相连接的D装置的导管口是_____
③为了能使产生的氧气被充分干燥,可采取的操作是
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知: 铜与氧气的反应有:①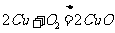 ,②
,②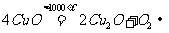 ;在酸性条件下:
;在酸性条件下: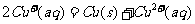 。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(
。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(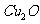 )。
)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有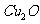 ,甲、乙、丙三同学分别设计如下实验方案。
,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有___
,则说明固体中含有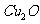 。
。
乙同学的实验方案是:再将粉末X放人氧气中加热,如果其质量增加,则说明其中含有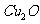 。
。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。若n的取值范围是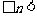 ,则粉末X中含有
,则粉末X中含有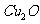 ,其物质的量是_____。
,其物质的量是_____。
请你再设计一个与上述三个实验方案中现象均不相同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有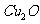 。写出该实验中反应的离子方程式。
。写出该实验中反应的离子方程式。
15.某金属M氯化物MCl2的相对分子质量为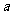 ,溶解度为Sg,现取质量为Wg的MCl2在一定温度下完全溶解,配成VmL饱和溶液,若溶液的密度为dg/cm3,溶液的物质的量浓度为cmol/L,溶液中溶质的质量分数为w%,则下列关系式中不正确的是
,溶解度为Sg,现取质量为Wg的MCl2在一定温度下完全溶解,配成VmL饱和溶液,若溶液的密度为dg/cm3,溶液的物质的量浓度为cmol/L,溶液中溶质的质量分数为w%,则下列关系式中不正确的是
A. 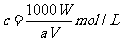 B.
B.
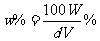
C. 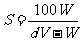 D.
D.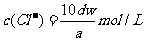
(必做部分)
14.下列反应均能自发的向右进行:2D-+A2=D2+2A-;2B-+D2=B2十2D-;2A-+C2=A2+2C-。由此得出的正确结论是
A.A-、B-、C-、D-离子中,还原性最强的是C-
B.A2、B2、C2、D2单质中,氧化性最强的是B2
C. 反应2B-+A2 =B2+2A-能够自发向右进行
D.反应2C-+B2=C2+2B-能够自发向右进行
13.已知1-18号元素的离子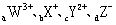 都具有相同的电子层结构,则下列关系正确的是
都具有相同的电子层结构,则下列关系正确的是
A.四种元素位于同一周期 B.离子的氧化性: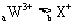
C. 氢化物的稳定性:H2Y>HZ D.a+3=c-2
12.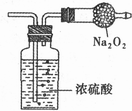 某无色气体可能由02、CO、CO2、HCl、NH3、NO、C12中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na202)后气体呈红棕色,则下列推断正确的是
某无色气体可能由02、CO、CO2、HCl、NH3、NO、C12中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na202)后气体呈红棕色,则下列推断正确的是
A.原气体中一定有NO和02
B.原气体中一定有NH3、NO、CO2、CO
C.原气体中一定没有CO
D.原气体中一定没有HCl、C12、02
11.单质X能从盐溶液中置换出单质Y,由此得到的下列一般规律中不正确的是
A.当X、Y都是金属时,X比Y活泼
B.当X、Y都是非金属时,X比Y活泼
C. 当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
10.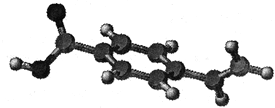 某有机物只含有C、H、O三种元素,其结构如右图所示,图中的短棍可以表示单键、双键或叁键。下列关于这种物质的说法中正确的是
某有机物只含有C、H、O三种元素,其结构如右图所示,图中的短棍可以表示单键、双键或叁键。下列关于这种物质的说法中正确的是
A.该有机物的化学式是C9H8O2
B.该有机物最多只能加成1mol的氢气
C. 该有机物只能发生加成反应,不能发生取代反应
D.该有机物不能够使酸性高锰酸钾溶液褪色
33.(8分)[化学一有机化学基础]
A、B、C、D、E、F、C、H均为含有苯环的有机物。B与PeCl3溶液混合没有颜色变化,F、H除苯环外还有一个含有氧的六元环(该六元环与苯环共用2个碳原子)。
它们之间的转化关系如下:
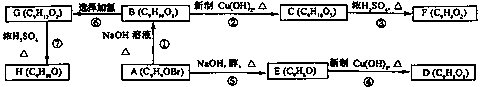
(1)除苯环外,化合物A还含有的官能团是_____。
(2)物质D不可能具有的性质是_____ (填写字母)。
A.使溴水褪色 B.使酸性KMnO4溶液褪色
C.能与Na2CO3溶液反应
D.能发生酯化反应
E.能与新制的Cu(0H) 2反应 F.能使PeCl3溶液变色
(3)写出反应①的化学方程式____。
(4)写出同时符合下列两项要求的C的两种同分异构体的结构简式
①化合物是1,3,5一三取代苯②苯环上的三个取代基中必须含有醇羟基、酚羟基和醛基这三种结构_____。
32.(8分)[化学一物质结构与性质]
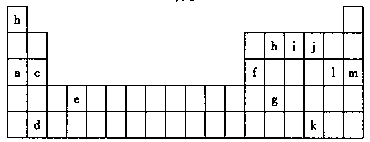
已知:表I是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
表I
表Ⅱ是一些气态基态原子的第一、二、三、四级电离能(kJ·mol-1):
表Ⅱ
|
|
锂 |
X |
Y |
|
第一电离能 |
519 |
502 |
580 |
|
第二电离能 |
7296 |
4570 |
1820 |
|
第三电离能 |
11799 |
6920 |
2750 |
|
第四电离能 |
|
9550 |
11600 |
请根据上述信息,回答下列问题:
(1)为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_____。
(2)表中Y可能为以上13种元素中的_____ (填写字母)元素。用元素符号表示 X和j形成的化学键种类最多的一种化合物的化学式_____。
(3)根据构造原理,用电子排布式表示e的特征电子构型_____。
(4)以上13种元素中,_____ (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)i元素另一元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属_____晶体,若使其熔化,需破坏的作用力为_____。
31.(8分)[化学-化学与技术]
烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如右图所示:
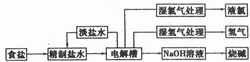
(1)电解饱和食盐水的总反应方程式为______,阳极发生的电极反应为_______。
(2)工业生产用的食盐水进入电解槽之前需精制,请简要说明需要精制的原因。
(3)目前氯碱工业主要采用的方法有三种,它们各有特点(见表)。
|
方法 |
电解槽特点 |
产品中氯 化钠含量 |
电解液中氢 氧化钠含量 |
总能耗 (kW.h·t-1) |
其他 |
|
隔膜法 |
使用石棉纤维制成的隔膜隔开阴阳极 |
较大 |
低 |
高 |
细微石棉吸入人的肺内有损健康,目前正被离子膜交换法取代 |
|
汞法 |
由独立的电解室和解汞室构成,氯气和氢气在不同的室产生 |
低 |
很高 |
高 |
汞易对环境造成污染,在我国已经被淘汰 |
|
离子交换膜法 |
使用能选择性通过离子的离子膜替代隔膜法中石棉隔膜 |
很低 |
较高 |
低 |
占地少、生产能力大、能连续生产,是氯碱工业的发展方向 |
请比较三种方法的优缺点,指出哪些方面的主要因素不断促进着电解槽革新。
(4)氯碱化工厂的选址比较特殊,如通常不会单独建氯碱化工厂,而是与农药厂、有机化工、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因和所带来的好处
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com