
12.下列各选项所述的两个量中,前者一定大于后者的是 ( )
A.纯水在100℃和25℃时pH
B.NH4Cl溶液中NH4+和Cl-的数目
C.相同温度下,pH相同的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-)
D.用0.1mol/L的盐酸中和pH、体积均相同的氨水和NaOH溶液,所消耗盐酸的体积
11.将某些话写知识用图象表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,不正确的是( )
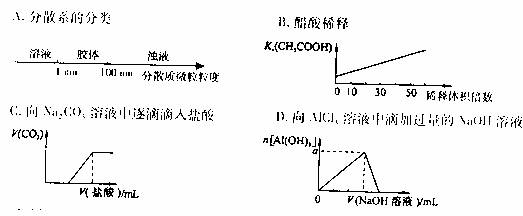
9.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中,正确的是 ( )
A.HCl的水溶液是强酸,HF的水溶液也是强酸
B.CH4的正四面体结构,SiH4也是正四面体结构
C.共价化合物中一定不含离子键、离子化合物中也一定不含共价键
D.CaCO3与稀HNO3反应生成CO2,CaSO3与稀HNO3反应生成SO2
|
A.H2与H3属于同素异形体 B.O2与O4属于同位素
C.C60的质量数为720g/mol D.N5+离子中含有36个电子
32.(8分)[化学-有机化学基础]
有机物A的结构简式为 它可通过不同化学反应分别制得B、C、D和E四种物质。
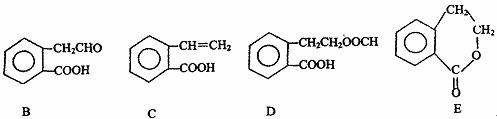
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
31.(8分)[化学一物质结构与性质]
X、Y、Z三种元素的核电荷数小于18,它们间能形成化合物YX2、ZX2。X原子最外电子层的p能级中有一个轨道填充了2个电子,Y原子的最外层中p能级的电子数等于前一电子层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为 ;
 (2)Y与Z形成的化合物中的化学键是
键(填“极性”或“非极性”),
(2)Y与Z形成的化合物中的化学键是
键(填“极性”或“非极性”),
该分子属于 分子(填“极性”或“非极性”)。
(3)Y的氢化物中分子构型为正四面体的是 (填名称)。
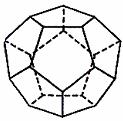
(4)德国和美国科学家首先制出由20个Y原子组成的空心笼状分子Y20,
该笼状结构是由许多正五边形构成(如右图)。请回答:Y20 分子共有 条棱边,Y20晶体属 于 (填晶体类型)。
30.(15分)氢氧化铜是一种常用试剂。如:利用氢氧化铜验证葡萄糖的还原性。
Ⅰ.新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10% 的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4-6滴,振荡即成。这样操作的目的 。
下面是三个研究性学习小组分别从不同层面开展的探究性学习活动:
Ⅱ.研究性学习小组甲:对“葡萄糖与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑:他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想: 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量稀硝酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重。反复多次,直到固体恒重,称得质量了bg,比较a、b的关系
方案4:取红色沉淀入试管里,加入酸化的硝酸银溶液,观察是否有白色的银析出
你认为合理的方案是 。
Ⅲ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示,你认为要测定上述沉淀成分必须测定下列哪些物理量: 。
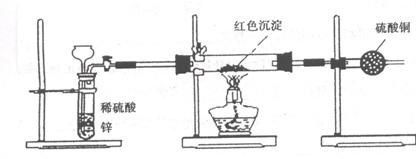
①通入氢气体积
②反应前,红色沉淀和硬质试管的总质量
③完全反应后,红色固体和硬质试管的总质量
④实验前,干燥管质量
⑤硬质试管质量
⑥锌粒质量
⑦稀硫酸中含溶质的量
⑧实验后,干燥管质量
Ⅳ.研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的化学家”,绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求,他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案 。
[选做部分]
共8小题,考生从中选择2个物理、1个化学和1个生物题目作答。
29.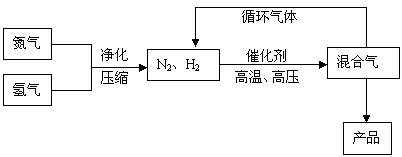 (15分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(15分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)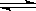 2NH3(g);其部分工艺流程如下:
2NH3(g);其部分工艺流程如下:
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g); △H=180kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g); △H=-906kJ/mol
2H2 (g)+O2(g)=2H2O(g); △H=-484kJ/mol
则N2(g)+3H2(g)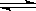 2NH3(g) 的△H= 。
2NH3(g) 的△H= 。
(2)如果工业上,在一定温度下,将10molN2气体和10molH2气体通入到体积为2升的闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。 改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数较小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法:
(填编号)。
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为: 。
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20 mol/L的氨水 mL。假如该氨水的pH= a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a (填“大于”“小于”或“等于”)。
28.(12分)A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族。
A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子。
(1)比D元素多一个质子的元素形成的单质与B、C形成最高价化合物的反应方程式是
。
(2)甲是由A、B、C三种元素组成的居室污染气体,主要来自装修材料和日用化学品等,甲的结构简式为 。乙是由甲中的两种元素组成,且与甲等电子,乙的分子式是 。
乙的一种重要的用途是 。
(3)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应化学方程式是为 。
(4)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是 。
15.将甲和乙气体同时通入过量丙溶液中,充分反应后一定产生沉淀的组合是( )
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
Ca(OH)2 |
|
② |
HCl |
CO2 |
Ca(OH)2 |
|
③ |
CO2 |
SO2 |
BaCl2 |
|
④ |
NO2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
⑥ |
O2 |
NH3 |
AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②④⑥ D.全部
第II卷 (必做120分+选做32分,共152分)
第Ⅱ卷共16大题,其中23-30题为必做部分,考生可用黑色签字笔、钢笔或圆珠笔直接将答案写在答题卷上;31-38题为选做部分,考生必须从中选择2个物理1个化学和1个生物题目作答,多选多做不计分。选做的题目,考生须将答案用黑色签字笔、钢笔或圆珠笔写在试卷规定的位置,且必须标明题号。
[必做部分]
14.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH = 4K2CO3+10H2O,有关此电池的推断正确的是( )
A.负极反应为14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.放电过程中KOH的物质的量浓度不变
D.每消耗1mol C2H6,则电路上转移的电子为14mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com