
33.(8分)[化学--有机化学基础]
M5纤维是美国开发的一种超高性能纤维,据报道,美国士兵佩带的头盔、防弹背心和刚性
前后防护板中含有M5纤维。M5纤维是刚杆形又有强力分子间氢键的聚合物。下面是M5纤维的合成线路:(有些反应未注明条件)
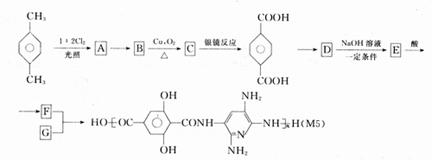
请填写下列空白:
(1)合成M5的单体的结构简式F._______________,G.___________________;
(2)反应类型:A→B:________________;B→C:________________ :
(3)在生成A的反应中,对二甲苯与氯气按物质的量之比1:2发生反应,生成A的同时 可能生成的A的同分异构体 _________________。(写结构简式);
(4)写出化学反应方程式:C→对苯二甲酸:________________________-。
32.(8分)[化学--物质结构与性质]
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为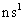 ,B元素的原子价电子排布为
,B元素的原子价电子排布为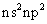 ,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
(1)C原子的电子排布式为_______,若A元素的原子最外层电子排布为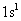 ,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于__________键。
,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于__________键。
(2)当n=2时,B的原子结构示意图为_______,B与C形成的晶体属于_______晶体。
当n=3时,B与C形成的晶体中微粒间的作用力是_______________。
(3)若A元素的原子最外层电子排布为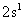 ,B元素的原子价电子排布为
,B元素的原子价电子排布为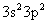 ,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 __________(用元素符号表示)。
,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 __________(用元素符号表示)。
31.(8分)[化学--化学与技术]
氢氧化钠是一种用途十分广泛的重要化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是____________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是_______.
(2)为使电解氯化钠的速度加快,下列措施中,可行的是_____________________。
A.增大阴极碳钢网面积 B.提高饱和氯化钠溶液的温度
C.加大阴极与阳极间的距离 D.提高电解时的电源电压
(3)如果将某离子交换膜电解槽有关条件进行如下改变,则能使电解速率一定会达到原来的2倍的是____________。
①电解时的电压增大到原来的2倍
②电解时的电流增大到原来的2倍
③电解时的温度从30℃提高到60℃
30.(15分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物未标出)。
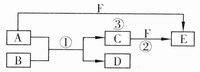
(1)若A、D、F都是非金属单质,常温下,A、D为固体,D单质可作为半导体材料,F为气体,且A、D所含元素为同主族短周期元素,A、F所含元素同周期,则反应①的化学方程式是___________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,C的溶液为浅绿色,则反应②(在水溶液中进行)的离子方程式是:_____________________________;已知1gD与足量F在光照的条件下完全反应生成B时,放出92.3 kJ热量,试写出该反应的热化学方程式:_______________。工业上可用电解方法同时制得D和F,写出电解过程中阳极的电极反应式:________________________________________.
(3)若B、C、F都是气态单质,且B有毒呈黄绿色,反应③中有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则反应③的化学方程式是_________________。
(4)若A、B、D为有机物,B的相对分子质量比A大14,E、F为无机物单质,C为最常见的氧化物,通常状况下为液态,C能与乙烯在一定条件下发生加成反应生成A。则E的化学式为_______________,D的结构简式为______________,反应①属于__________反应,反应③的化学方程式为_______________
(选做部分)
29.(13分)已知25℃时CH3COOH和NH3·H2O的电离平衡常数分别为
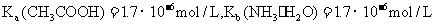 。现有常温下1 mol/L的醋酸溶液和1 mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
。现有常温下1 mol/L的醋酸溶液和1 mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为:____________,在同样条件下,该浓度的氨水的pH=__________(用含a的代数式表达)。
(2)将上述两种溶液等体积混合,所得溶液的pH=___________。
(3)饱和氯化铵溶液显酸性,原因是___________;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解,合理的解释用相关离子方程式表示为______________________
(4)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,Mg(OH)2能否完全溶解________(填“能”或“否”),理由是____________________ 。
28.(14分)某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(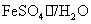 )和胆矾晶体(
)和胆矾晶体(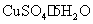 ),其实验方案如下:
),其实验方案如下:
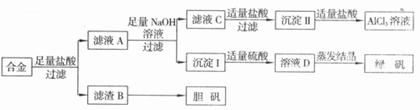
试回答下列问题:
(1)过滤用的玻璃仪器有_______________________。
(2)写出由沉淀Ⅱ转化为AlC13溶液的离子方程式_____________________。
(3)小组成员经过检测.发现制得的绿矾不纯,试分析原因___________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进_________________________
(4)小组成员从资料中获知H2O;是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O:来制备胆矾晶体,则该反应的总化学方程式为________________________________
(5)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前方案______(填“更合理”或“不合理”),理由是_____
15.室温下,下列混合溶液中,各离子浓度的关系表示正确的是
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合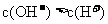
B.浓度均为0.1 mol/L的硫酸氢铵溶液和氢氧化钠溶液等体积混合
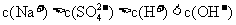
C.浓度均为0.1 mol/L的小苏打溶液和氢氧化钠溶液等体积混合
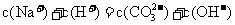
D.浓度均为0.1 mol/L的醋酸溶液和氢氧化钠溶液等体积混合
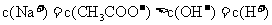
第Ⅱ卷(必做120分十选做32分,共152分)
第Ⅱ卷共16个题。其中23-30题为必做部分,31-38题为选做部分,考生必须从中选择2个物理、1个化学和1个生物题作答。不按规定选做者,阅卷时将根据所选科目题号的先后顺序只判前面的2个物理题、1个化学题和1个生物题,其他作答的题目答案无效。
(必做部分)
14.下列表示式中,书写正确的是
A.氢氧燃料电池的正极反应式: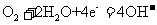
B.电解饱和食盐水的离子方程式: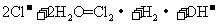
C. 298 K时,已知1 mol碳充分燃烧放出393.5 kJ热量,1 mo1CO充分燃烧放出283.0 kJ热量,则C(s,石墨)+ 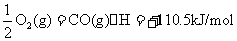
D.氯化铵水解的离子方程式: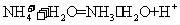
13.元素甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A.原子半径:丙的>乙的>甲的>丁的
B.气态氢化物的稳定性:甲的>丙的
C.最高价氧化物对应的水化物的酸性:丁的>甲的
D.乙和甲或乙和丁所能形成的化合物都是剧毒物质
12.常温下在pH=3的溶液中,下列各组离子有可能大量共存的是
A.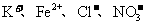 B.
B.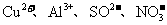
C. 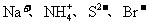 D.
D.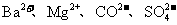
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com