
2.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为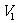 和
和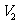 ,则
,则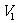 和
和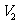 的关系正确的是
的关系正确的是
A.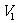 >
>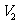 B.
B.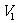 <
<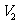 2 C.
2 C.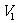 =
=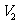 D.
D.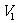 ≤
≤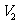 2
2
1.将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积交小、pH交大、呈碱性
D.水的离子积变大、pH变小、呈中性
25.(10分)
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C)在氧气流中充分反应,得到CO2气体224mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
24.(8分)
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
23.(10分)
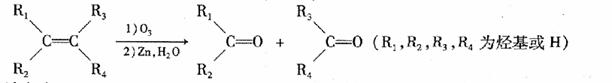
物质A(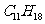 )是一种不饱和烃,它广泛存在于自然界中,也是重要的有机合成中间体之一。某化学实验小组从A经反应①到⑤完成了环醚F的合成工作:
)是一种不饱和烃,它广泛存在于自然界中,也是重要的有机合成中间体之一。某化学实验小组从A经反应①到⑤完成了环醚F的合成工作:
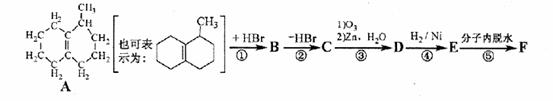
该小组经过上述反应,最终除得到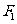 (
(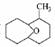 )外,还得到它的同分异构体,其中B、C、D、E、F分别代表一种或多种物质。
)外,还得到它的同分异构体,其中B、C、D、E、F分别代表一种或多种物质。
请完成:
(1)写出由A制备环醚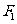 ,的合成路线中C的结构简式:___▲___。
,的合成路线中C的结构简式:___▲___。
(2)①写出B的一种结构简式:___▲___;②写出由该B出发经过上述反应得到的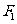 的同分异构体的结构简式:___▲___。
的同分异构体的结构简式:___▲___。
(3)该小组完成由A到F的合成工作中,最多可得到__▲__中环醚化合物。
22.(8分)
肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
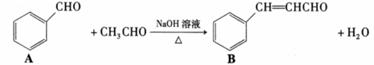
(1)请推测B侧链上可能发生反应的类型___▲___。(任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:___▲___。
(3)请写出同时满足括号内条件的B的所有同分异构体的结构简式:___▲___。( ①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构。)
21.(10分)
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有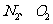 外,还含有
外,还含有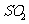 、微量的
、微量的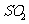 和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的
和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的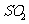 转化为有用的副产品。请按要求回答下列问题:
转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通人氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:___▲___、___▲___。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加人氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是___▲___ ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为___▲___;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是___▲___。
(3)能用于测定硫酸尾气中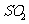 :含量的是___▲___。(填字母)
:含量的是___▲___。(填字母)
A.Na0H溶液、酚酞试液 B.KMn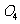 、溶液、稀
、溶液、稀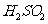
C.碘水、淀粉溶液 D.氨水、酚酞试液
20.(10分)
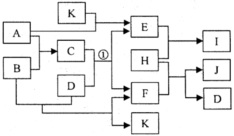 右图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3,溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。
右图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3,溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。
请回答下列问题:
(1)I的化学式为___▲___ ; J的电子式为___▲___ 。
(2)反应①的化学方程式为___▲___。
(3)F的水溶液与氯气反应的离子方程式为 ___▲___ 。
19.(8分)
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: ▲ ; B: ▲ ; C: ▲ ; D: ▲ 。
(2)写出A、B、E三种微粒反应的离子方程式: ▲ 。
18.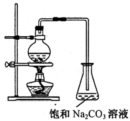 (12分)
(12分)
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应: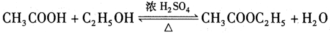
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有: ▲ 、 ▲ 等。
(2)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为: ▲ 、 ▲ 等。
(3)此反应以浓硫酸为催化剂,可能会造成 ▲ 、 ▲ 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度 /℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
 100 100 |
|
﹡选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 ▲ (填字母)为该反应的最佳条件。
A.120°C,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120°C时,反应选择性降低的原因可能为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com